Des équipes multidisciplinaires de bon usage des antimicrobiens (AMS) sont indispensables pour la mise en œuvre et la gestion des interventions en fonction des besoins de chaque hôpital.Afin de promouvoir une utilisation optimale des antibiotiques, les pharmaciens, de préférence avec une formation sur les maladies infectieuses (MI), jouent un rôle très important au sein de l'équipe AMS, car ils sont aptes à optimiser la posologie, la voie d'administration et la durée de la thérapie
antimicrobienne, ainsi qu’à émettre des avertissements à propos des interactions éventuelles entre les antimicrobiens et les autres médicaments administrés au patient.Les pharmaciens, même s'ils ne sont pas spécialisés, jouent donc un rôle de premier plan dans les équipes AMS.1–3
Ce guide décrit le travail quotidien du pharmacien au sein du programme AMS et son rôle au sein de l'équipe AMS.Ce guide propose des idées et des exemples des façons de profiter de l’expertise des pharmaciens dans le cadre des ASP.Les recommandations contenues dans ce guide sont conformes aux recommandations fondées sur les preuves destinées à la mise en œuvre des programmes AMS et émises par l’Infectious Diseases Society of America (IDSA)/Society for Healthcare Epidemiology of America (SHEA),1 les directives de l’organisation mondiale de la Santé (OMS) pour la mise en œuvre des programmes AMS dans les pays à revenu faible ou intermédiaire4, l'American Society of Health-System Pharmacists (ASHP) et sa déclaration sur le rôle du pharmacien dans l'AMS3 et la déclaration de la South African Society of Clinical Pharmacy (SASCOCP) sur le rôle du pharmacien dans le bon usage des antibicrobiens.5
Ces dernières années, la contribution des pharmaciens aux projets AMS est devenue cruciale3 Bien que les microbiologistes cliniques et les spécialistes des MI soient traditionnellement chargés de fournir des conseils sur la gestion des infections en Afrique et au Moyen-Orient, de nombreux pharmaciens impliqués dans la pratique clinique ont désormais acquis des fonctions qui complètent l'expertise des équipes multidisciplinaires d’AMS, en particulier dans les hôpitaux de soins secondaires et tertiaires.b
Des études menées dans les hôpitaux ont montré que les interventions des pharmaciens permettent d’améliorer l'utilisation appropriée des antimicrobiens et réduisent les coûts.6-8
Les interventions typiques comprennent des recommandations spécifiques au patient sur les choix thérapeutiques, la mise en œuvre des politiques institutionnelles de l’AMS, l’éducation, le suivi thérapeutique pharmacologique (STP) et la participation aux visites de l'unité de soins intensifs et aux réunions de l'AMS.6-8 Voici des exemples de résultats atteints lors de la mise en œuvre de ces
interventions:
- Les hôpitaux proposant une thérapie aux aminoglycosides ou à la vancomycine gérée par un pharmacien présentaient des taux de mortalité inférieurs de 6,7 % et une durée de séjour (DS) inférieure de 12,3 % à ceux des hôpitaux qui ne les incluaient pas dans le programme9
- Une étude menée dans un hôpital aux ressources limitées aux États-Unis a démontré que les pharmaciens peuvent mettre en œuvre des programmes AMS dans les hôpitaux de façon efficace, ce qui permet des interventions économiques, même avec des ressources restreintes en MI6
- Deux ans après avoir mis en place un programme AMS dirigé par un pharmacien sans aucun médecin en MI, environ $355,000 USD ont été économisés au niveau d’un établissement6
- La mise en place d'un AMS 24h/24 coordonné par le pharmacien dans un hôpital communautaire a réduit les dépenses en antimicrobiens de 14,46 USD par jour-patient ajusté à 11,22 USD par jour-patient ajusté après 12 mois.10
- En Afrique du Sud, une intervention nationale d'audit et de feedback menée par un pharmacien non spécialisé a considérablement amélioré le « temps d’attente » (entre la prescription et la perfusion) dans 33 hôpitaux simultanément11
- Une intervention menée par des pharmaciens ciblant le médicament « à portée de main » dans 47 hôpitaux sud-africains a entraîné une réduction durable de 18 % de la dose quotidienne définie d'antibiotiques12
- Les pharmaciens peuvent également améliorer les mesures de diagnostic, comme en témoigne une intervention sur la pneumonie communautaire acquise dans 39 hôpitaux sud-africains, où l'utilisation appropriée des radiographies pulmonaires et des cultures microbiologiques ont été considérablement améliorées13
aAdaptatéion d’Antimicrobial Stewardship in Australian Health Care.2018. https://www.safetyandquality.gov.au
bProfesseur Adrian Brink et Docteur Ali Omrani, avis d'expert.
Figure 1

AMS, le bon usage des antimicrobiens ; ASP, programme de bon usage des antimicrobiens ; IV, voie intraveineuse
aAdaptation de Garau J et Bassetti M. Int J Clin Pharm.2018 ; 40 (5) : 948-52.
- Encourager la collaboration multidisciplinaire au sein de l'hôpital pour s'assurer que la thérapie prophylactique, empirique et directe d'agents antimicrobiens aboutit à des résultats optimaux pour les patients. Ces activités peuvent inclure l'aide aux spécialistes en MI et au responsable du programme dans la bonne sélection, la posologie optimale, le début rapide, la surveillance appropriée et la réduction du spectre des thérapies antimicrobiennes, ainsi que la participation à l'élaboration de recommandations de traitement. Le rôle important du pharmacien clinicien consiste à générer (et préparer si besoin) des protocoles standardisés de dispensation d'antimicrobiens et à optimiser la voie, l'ajustement de la posologie en fonction de l’état rénal ou hépatique, ainsi que de la durée.
- Travailler au sein du comité thérapeutique et de pharmacie (ou équivalent), qui peut inclure les spécialistes en MI et le responsable d’AMS, pour s'assurer que le nombre et les types d'agents antimicrobiens disponibles soient appropriés, conformément aux recommandations sur les antimicrobiens. Ces décisions doivent être fondées sur les besoins de tous les patients, y compris les populations particulières de patients et les tendances microbiologiques au sein de l'hôpital
- Contribuer aux objectifs définis par l'équipe AMS concernant les résultats pour les patients, afin d'évaluer l'efficacité des politiques d'utilisation des antimicrobiens à l'hôpital
- Générer et analyser des données quantitatives sur les antimicrobiens (DDD, jours de traitement, durée de séjour, etc.) sur l'utilisation des antimicrobiens à des fins d’analyse de résultats cliniques et économiques
- Collaborer avec le laboratoire, les spécialistes en MI et les agents de prévention des infections pour rédiger des rapports de sensibilité (au moins une fois par an) afin de les familiariser avec les différentes unités hospitalières en vue de guider la thérapie empirique
- Utiliser les technologies de l'information et les outils d'aide à la décision clinique dans la mesure du possible pour améliorer l'AMS en mettant en place des alertes informatiques liés à la posologie incorrecte des antimicrobiens, à la durée, aux interactions médicamenteuses et à la thérapie combinée
- Faciliter des pratiques sûres de gestion des médicaments pour les agents antimicrobiens en utilisant des systèmes efficients et efficaces pour réduire les erreurs potentielles et les événements indésirables liés aux médicaments
Réduire la transmission des infections au sein de la pharmacie
- Participer au comité de prévention et de contrôle des infections (ou son équivalent)
- Établir des politiques, des procédures et des programmes de contrôle qualité internes à la pharmacie afin de prévenir la contamination des produits pharmaceutiques préparés ou distribués par le département de pharmacie.
Les protocoles du pharmacien sont d'une extrême importance pour la préparation et la manipulation de produits stériles - Mettre en œuvre des procédures de nettoyage de l'équipement pharmaceutique (par exemple, hottes à flux d'air laminaire et machines de préparation en vrac) et établir des politiques de personnel appropriées (par exemple, limiter les activités des membres du personnel qui présentent des symptômes d'une maladie respiratoire virale ou d'une autre affection infectieuse)
- Recommander un étiquetage, une datation et un stockage appropriés des produits stériles et des contenants de produits stériles à doses multiples (le cas échéant)
- Promouvoir le respect des précautions standards par les professionnels de santé, les patients et les autres personnes qui interviennent dans l'environnement des soins aux patients
aAdaptaté de :ASHP Statement on the Pharmacist’s Role in Antimicrobial Stewardship and Infection Prevention and
Control.Am J Health-Syst Pharm.2010 ; 67 : 575-7.
L’IDSA/SHEA recommandent que tous les programmes AMS incluent une forme d'autorisation préalable ou d'audit prospectif, ou une combinaison des deux.1 Ces interventions essentielles peuvent être effectuées par un pharmacien car elles sont essentielles au succès de l'audit prospectif et au retour d'expérience dans de nombreux hôpitaux du monde. Un exemple en est le programme AMS à l'hôpital général de Singapour (Figure 1).16 Les pharmaciens peuvent également être chargés d'évaluer la pertinence des prescriptions d'antibiotiques nécessitant une autorisation préalable et de contacter le prescripteur lorsque la prescription ne correspond pas ou ne respecte pas les critères d'approbation.20
Les antibiotiques nécessitant une autorisation préalable ou un audit sont soigneusement sélectionnés en fonction des variables suivantes:
- Action à large spectre16,21
- Possibilité de contribuer à la résistance16,21
- Possibilité d’utilisation superflue ou incorrecte16,21
- Nécessité de réserver au traitement des infections multirésistantes12
- Coûts élevés16,21
- Risque d'effets indésirables graves21
- Durée12
- Couverture antibiotique redondante ou dite double12
Les carbapénèmes, les fluoroquinolones et les glycopeptides en sont des exemples de classes d'antibiotiques souvent contrôlées en réponse à une forte consommation et à l'émergence de résistances dans les hôpitaux.16,18,22,23
La nomenclature hospitalière doit être régulièrement examinée et mise à jour en fonction des données sur la consommation et la résistance aux antibiotiques.24
Figure 1
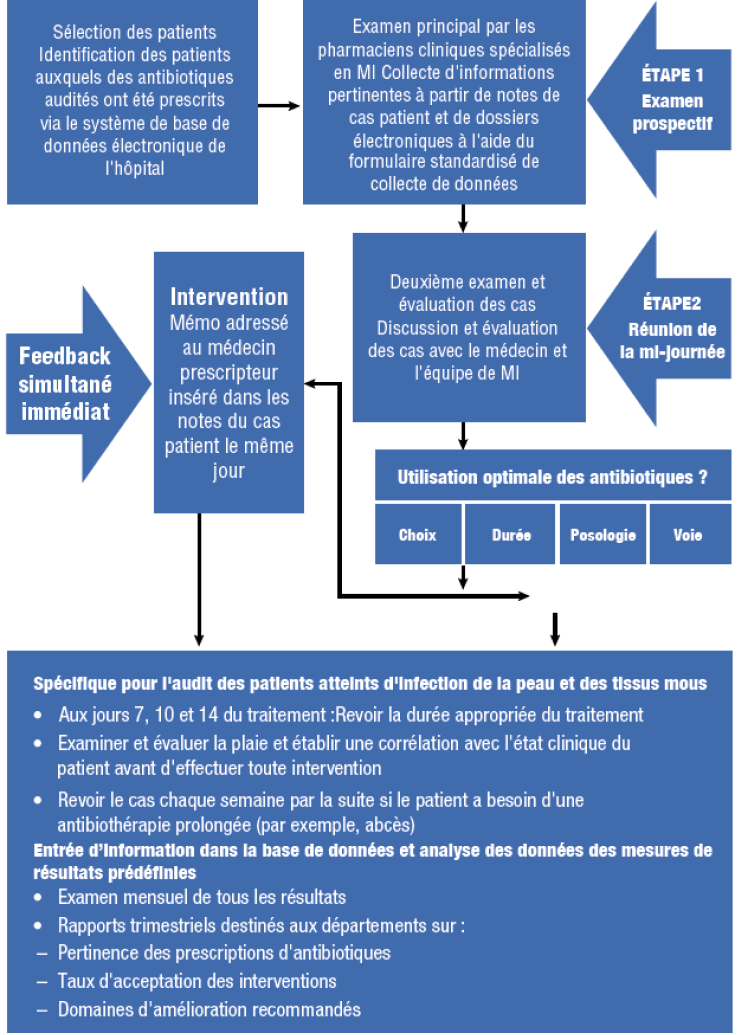
AMS, le bon usage des antimicrobiens ; MI, maladie infectieuse ; IV voie intraveineuse
Adapté de :Teo J, et al.Eur J Clin Microbiol Infect Dis.2021 ; 31 : 947-955 ; Liew YX, et al.
Int J Antimicrob Agents.2012 ; 40 : 55-60 ; Loo LW, et al.Infect Dis Ther.2015 ; 4 (Suppl 1) :15-25.
Les outils et les stratégies AMS suivants sont couramment intégrés dans le processus d'examen des antibiotiques par le pharmacien :16
- Recommandations antibiotiques spécifiques à l'hôpital
- Désescalade
- Passage de l’administration intraveineuse (IV) à la prise orale
- Optimisation des doses
- Interaction médicamenteuse
Lorsqu'elles sont disponibles, les recommandations de traitement antibiotique spécifiques à l'hôpital doivent être utilisées par les pharmaciens comme référence pour évaluer la pertinence du traitement, y compris le choix et la durée du traitement antibiotique, ainsi que des recommandations aux médecins concernant tout changement de traitement.27,28 Les recommandations spécifiques à l'hôpital doivent correspondre à la nomenclature de l'hôpital et aux schémas de sensibilité bactérienne qui fait partie de l’antibiogramme hospitalier.28 Ces recommandations contiennent généralement des recommandations sur les antibiotiques et d'autres conseils utiles pour les infections couramment traitées, y compris, mais sans s'y limiter :28
- Pneumonie communautaire
- Pneumonie nosocomiale et acquise sous ventilation
- Infections de la peau et des tissus mous
- Infections des voies urinaires
- Infections intra-abdominales
- Septicémie
- Les résultats microbiologiques ne sont généralement pas disponibles avant 24 à 72 heures
- L'antibiothérapie initiale est donc généralement empirique et guidée par le profil clinique du patient et l'épidémiologie localeb
- Lorsque l'agent pathogène à l'origine de l'infection est identifié, une antibiothérapie définitive dirigée contre l'agent pathogène peut être démarrée
bProfesseur Adrian Brink et Dr Ali Omrani, avis d'expert.
Tableau 2
| Thérapie empirique | Thérapie définitive | |
|---|---|---|
Critères de
|
|
|
Critères pour la
|
|
aAdapté du Lew KY, et al. J Antimicrob Chemother. 2015 ; 70 : 1219-25.
Figure 2
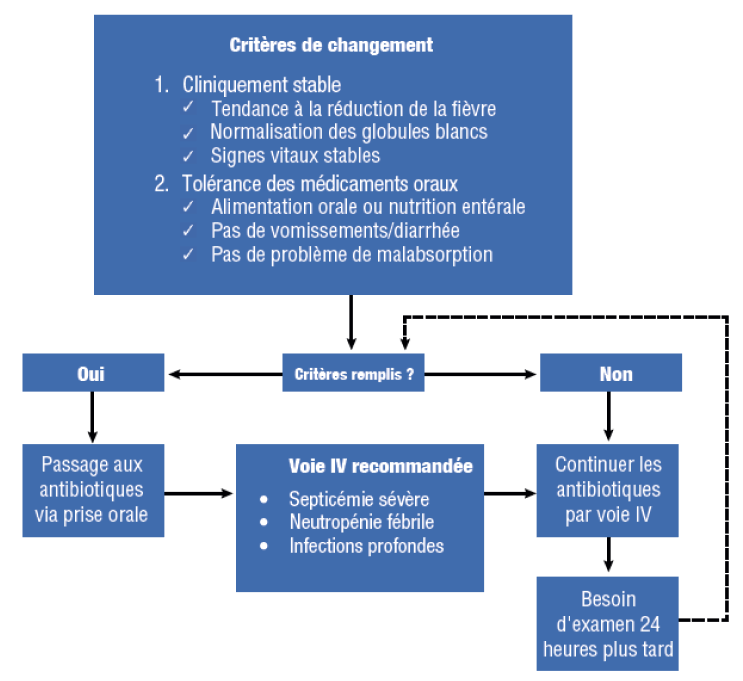
aAdapté de Teo J, et al. Eur J Clin Microbiol Infect Dis. 2012 ; 31 : 947-55.
de l'équipe AMS
(Figure 3).1,2 Le co-directeur pharmacien doit soutenir le chef d'équipe dans ses tâches, et notamment :1,2
- La mise à jour des recommandations thérapeutiques
- L’audit antibiotique et choix de nomenclature
- Des conseils et une formation AMS au personnel hospitalier concerné
Dans les hôpitaux où les médecins en MI ne sont pas disponibles, un pharmacien clinicien, de préférence avec un internat en pharmacothérapie des MI, peut être appelé à diriger l'équipe.2 Dans un tel contexte, le pharmacien est tenu de mettre en œuvre et d’assurer la pérennité du programme AMS.29
Dans de nombreux pays d'Afrique et du Moyen-Orient, les pharmaciens spécialisés peuvent ne pas être disponibles et, comme démontré par des études sud-africaines, l'AMS peut être dirigée par des pharmaciens non spécialisés.11–13
Figure 3
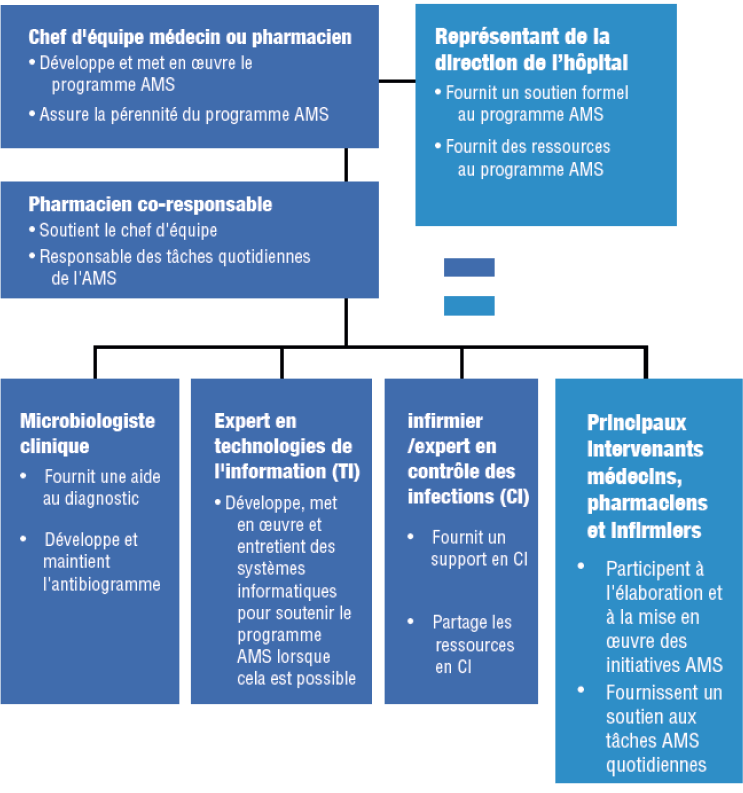
Bon usage des antimicrobiens (AMS, antimicrobial stewardship)
aAdapté de Dellit HT, et al. Clin Infect Dis. 2007 ; 44 : 159 77.
Un programme AMS dirigé par un pharmacien
Contexte
- Petit hôpital communautaire, aucun médecin spécialiste en MI n’est disponible pour consultation de routine
- Facilement applicable aux hôpitaux avec peu ou pas de support médical en MI.
Profil de pharmacien
- Grand intérêt et expérience dans la pratique des MI
- Aucune formation post-universitaire en MI, mais l’intérêt pour les MI et l'AMS
Rôle du pharmacien
- 0,9 équivalent temps plein
- Préparation de 6 mois aux stratégies éducatives et promotionnelles :
- Présentations lors de réunions du personnel médical
- Discussions avec des médecins sur les perceptions d'un programme AMS dirigé par un pharmacien
- Formation du personnel de la pharmacie au nouveau programme et aux idées de mise en œuvre
- Communication par courriel destinée au personnel médical afin de les informer de l’avancement de la mise en œuvre du programme
- Tâches de routine:
- Analyse manuelle de tous les cas patients recevant des antibiotiques avec des discussions en face à face avec les prescripteurs pour recueillir leurs recommandations en vue de :
» Soutien au processus d'examen de l'équipe AMS
» Respect des recommandations antimicrobiennes
» Désescalade thérapeutique antimicrobienne - Disponible par téléphone pour répondre aux questions en dehors des horaires de travail concernant l'antibiothérapie si un spécialiste en MI n'est pas disponible
- Former le personnel hospitalier de façon formelle et informelle sur l'utilisation optimale des antibiotiques
- S’entretenir régulièrement avec les directeurs de pharmacie et les directeurs médicaux, ainsi qu'un praticien hospitalier et celui des soins intensifs, pour recevoir le feedback sur la façon dont le programme pourrait être amélioré
- Envoyer des rapports mensuels au directeur de la pharmacie et à la direction de l'hôpital avec les détails des interventions et les économies de coûts effectués, les succès du programme et les domaines à améliorer
- Utilisation réduite d'antibiotiques ciblés, tels que les carbapénèmes
- Réduction de la durée d'hospitalisation des patients atteints de pneumonie communautaire
- Réduction des coûts des antibiotiques (DDD et jours de traitement [DOT])
AMS
Les pharmaciens non spécialisés en MI peuvent facilement faire des efforts personnels pour améliorer leurs connaissances des problèmes liés aux MI et à l'AMS.2,36 Les façons d’y arriver sont nombreuses:
- Se familiariser avec les principales recommandations de pratique clinique en matière des MI fondées sur les preuves, dont beaucoup sont disponibles sur l'IDSA (IDSA Practice Guidelines (idsociety.org)) and ESCMID (https://www.escmid.org/escmid-publications/clinical-microbiology-and-infection-cmi) websites
- Utiliser des ressources pédagogiques, telles que celles fournies par l'ASHP (www.ashp.org), les Centers for Disease Control and Prevention (www.cdc.gov/antibiotic-use/healthcare/index.html), l'OMS (https://www.who.int/publications/i/item/9789241515481), et le Center for Infectious Disease Research and Policy (www.cidrap.umn.edu/asp)
- Assister à des conférences avec un médecin en MI
- Visiter des institutions avec des programmes AMS existants
- Compléter un programme de certification pour les pharmaciens, comme celui fourni par la par la Société des pharmaciens des maladies infectieuses (plus d'informations sont disponibles à: https://sidp.org/Stewardship-Certificate)
Le succès des programmes AMS dans les hôpitaux de l'Afrique et du Moyen-Orient repose sur les efforts quotidiens de pharmaciens dévoués avec et sans formation formelle postdoctorale en MI. Idéalement, l’AMS devrait se faire en partenariat de collaboration entre les pharmaciens et les médecins, avec le soutien d'autres membres de l'équipe AMS.b
Le rôle du pharmacien spécialiste des maladies non infectieuses dans la promotion de l'engagement interdisciplinaire dans les programmes de gouvernance dans les hôpitaux ou dans les systèmes de santé en Afrique et au Moyen-Orient ne devrait pas être sous-estimé.b Les modèles des compétences et d'apprentissage partagé en matière de gouvernance à l’instar de l’Afrique du Sud peuvent profiter aux pays à revenu faible ou intermédiaire.13
bProfesseur Adrian Brink et Docteur Ali Omrani, avis d'expert.
- Barlam TF, Cosgrove SE, Abbo LM, MacDougall C, Schuetz AN, Septimus EJ, et al. Implementing an antibiotic stewardship program: Guidelines by the Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America. Clin Infect Dis Off Publ Infect Dis Soc Am. 2016;62(10):e51–e77.
- American Society of Health-System Pharmacists. A hospital pharmacist’s guide to antimicrobial stewardship programs. Available at: https://www.ashp.org/Products-and-Meetings-Aliases/The- Pharmacists-Guide-to-Antimicrobial-Therapy-and-Stewardship. Consulté en avril 2020.
- American Society of Health-System Pharmacists. ASHP statement on the pharmacist’s role in antimicrobial stewardship and infection prevention and control. Am J Health Syst Pharm. 2010;67(7):575–7.
- World Health Organization. Antimicrobial stewardship programmes in health-care facilities in low- and middle-income countries: a WHO practical toolkit. October 2019. Available at: https://www.who.int/ publications/i/item/9789241515481. Consulté en juin 2021.
- Schellack N, Bronkhorst E, Coetzee R, Godman B, Gous AGS, Kolman S, et al. SASOCP position statement on the pharmacist’s role in antibiotic stewardship 2018. Afr J Infect Dis. 2018;33(1):28–35.
- Waters CD. Pharmacist-driven antimicrobial stewardship program in an institution without infectious diseases physician support. Am J Health-Syst Pharm. 2015;72(6):466–8.
- von Gunten V, Reymond J-P, Beney J. Clinical and economic outcomes of pharmaceutical services related to antibiotic use: a literature review. Pharm World Sci PWS. 2007;29(3):146–63.
- Boyles TH, Whitelaw A, Bamford C, Moodley M, Bonorchis K, Morris V, et al. Antibiotic stewardship ward rounds and a dedicated prescription chart reduce antibiotic consumption and pharmacy costs without affecting inpatient mortality or re-admission rates. PloS One. 2013;8(12):e79747.
- Bond CAC and Raehl CL. Clinical and economic outcomes of pharmacist-managed aminoglycoside or vancomycin therapy. Am J Health-Syst Pharm AJHP Off J Am Soc Health-Syst Pharm. 2005;62(15):1596–605.
- Davis S, Newcomer D, Bhayani NK. Development and evolution of a 24-hour pharmacist-coordinated antimicrobial stewardship service in a community hospital. Hosp Pharm. 2014;49(8):685–8.
- Messina AP, Van den Bergh D, Goff DA. Antimicrobial Stewardship with Pharmacist Intervention Improves Timeliness of Antimicrobials Across Thirty-three Hospitals in South Africa. Infect Dis Ther. 2015;4(Suppl 1):5–14.
- Brink AJ, Messina AP, Feldman C, Richards GA, Becker PJ, Goff DA, et al. Antimicrobial stewardship across 47 South African hospitals: an implementation study. Lancet Infect Dis. 2016;16(9):1017–25.
- van den Bergh D, Messina AP, Goff DA, Van Jaarsveld A, Coetzee R, De Wet Y, et al. A pharmacist-led prospective antibiotic stewardship intervention improves compliance to community-acquired pneumonia guidelines in 39 public and private hospitals across South Africa. Int J Antimicrob Agents. 2020;56(6):106189.
- Garau J and Bassetti M. Role of pharmacists in antimicrobial stewardship programmes. Int J Clin Pharm. 2018;40(5):948–52.
- ASHP statement on the pharmacist’s role in antimicrobial stewardship and infection prevention and control. Am J Health-Syst Pharm AJHP Off J Am Soc Health-Syst Pharm. 2010;67(7):575–7.
- Teo J, Kwa ALH, Loh J, Chlebicki MP, Lee W. The effect of a whole-system approach in an antimicrobial stewardship programme at the Singapore General Hospital. Eur J Clin Microbiol Infect Dis. 2012;31(6):947–55.
- Chang Y-Y, Chen H-P, Lin C-W, Tang J-J, Hsu T-Y, Weng Y-C, et al. Implementation and outcomes of an antimicrobial stewardship program: Effectiveness of education. J Chin Med Assoc JCMA. 2017;80(6):353–9.
- Wang H-Y, Chiu C-H, Huang C-T, Cheng C-W, Lin Y-J, Hsu Y-J, et al. Blood culture-guided de-escalation of empirical antimicrobial regimen for critical patients in an online antimicrobial stewardship programme. Int J Antimicrob Agents. 2014;44(6):520–7.
- Dellit TH, Owens RC, McGowan JE, Gerding DN, Weinstein RA, Burke JP, et al. Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America guidelines for developing an institutional program to enhance antimicrobial stewardship. Clin Infect Dis. 2007;44(2):159–77.
- Public Health Ontario. Antimicrobial stewardship strategy: Formulary restriction with preauthorization. Available at: www. publichealthontario.ca/en/BrowseByTopic/InfectiousDiseases/ AntimicrobialStewardshipProgram/Documents/ASP_Strategy_ Formulary_Restriction_Preauthorization.pdf. Consulté en avril 2020.
- Public Health Ontario. Antimicrobial stewardship strategy: Formulary restriction. Available at: www. publichealthontario.ca/en/BrowseByTopic/InfectiousDiseases/ AntimicrobialStewardshipProgram/Documents/ASP_Strategy_ Formulary_Restriction.pdf. Consulté en avril 2020.
- Liew YX, Lee W, Loh JCZ, Cai Y, Tang SSL, Lim CLL, et al. Impact of an antimicrobial stewardship programme on patient safety in Singapore General Hospital. Int J Antimicrob Agents. 2012;40(1):55–60.
- Cheon S, Kim M-J, Yun S-J, Moon JY, Kim Y-S. Controlling endemic multidrug-resistant Acinetobacter baumannii in Intensive Care Units using antimicrobial stewardship and infection control. Korean J Intern Med. 2016 ; 31(2) : 367-74.
- Public Health Ontario. Antimicrobial stewardship strategy: Formulary review/ streamlining.Disponible sur : www. publichealthontario.ca/en/BrowseByTopic/InfectiousDiseases/ AntimicrobialStewardshipProgram/Documents/ASP_Strategy_ Formulary_Review.pdf. Consulté en avril 2020.
- Liew YX, Lee W, Kwa AL-H, Chlebicki MP. Cost effectiveness of an antimicrobial stewardship programme. Int J Antimicrob Agents. 2015 ; 46 (5) : 594-5.
- Loo LW, Liew YX, Lee W, Chlebicki P, Kwa AL-H. Impact of antimicrobial stewardship program (ASP) on outcomes in patients with acute bacterial skin and skin structure infections (ABSSSIs) in an acute-tertiary care hospital. Infect Dis Ther. 2015;4(Suppl 1): 15–25.
- Kalil AC, Metersky ML, Klompas M, Muscedere J, Sweeney DA, Palmer LB, et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis. 2016;63(5):e61–e111.
- Levy Hara G, Kanj SS, Pagani L, Abbo L, Endimiani A, Wertheim HFL, et al. Ten key points for the appropriate use of antibiotics in hospitalised patients: a consensus from the Antimicrobial Stewardship and Resistance Working Groups of the International Society of Chemotherapy. Int J Antimicrob Agents. 2016;48(3):239–46.
- Leekha S, Terrell CL, Edson RS. General principles of antimicrobial therapy. Mayo Clin Proc. 2011;86(2):156–67.
- Liew YX, Lee W, Tay D, Tang SSL, Chua NGS, Zhou Y, et al. Prospective audit and feedback in antimicrobial stewardship: is there value in early reviewing within 48 h of antibiotic prescription? Int J Antimicrob Agents. 2015;45(2):168–73.
- Park SM, Kim H, Jeong YM, Lee JH, Lee E, Lee E, et al. Impact of intervention by an antimicrobial stewardship team on conversion from intravenous to oral fluoroquinolones. Infect Chemother. 2017;49(1):31–7.
- Lew KY, Ng TM, Tan M, Tan SH, Lew EL, Ling LM, et al. Safety and clinical outcomes of carbapenem de-escalation as part of an antimicrobial stewardship programme in an ESBL-endemic setting. J Antimicrob Chemother. 2015;70(4):1219–25.
- Doron S and Davidson LE. Antimicrobial stewardship. Mayo Clin Proc. 2011;86(11):1113–23.
- How to make antimicrobial stewardship work: Practical considerations for hospitals of all sizes. Available at: https://journals. sagepub.com/doi/abs/10.1310/hpj4511-s10. Consulté en avril 2020.
- Centers for Disease Control and Prevention. Core elements of hospital antibiotic stewardship programs. Available at: https:// www.cdc.gov/antibiotic-use/healthcare/pdfs/core-elements.pdf. Consulté en avril 2020.
- Patel D and MacDougall C. How to make antimicrobial stewardship work: Practical considerations for hospitals of all sizes. Hosp Pharm. 2010;45(11 Suppl):S10–S18.
Il est entièrement gratuit de télécharger instantanément des matériels ou de les faire poster pour vous par l'intermédiaire de notre service de commande par correspondance.