Les indicateurs clés de performance (ICP) du programme de bon usage des antimicrobiens (AMS, antimicrobial stewardship) servent à évaluer le niveau d'avancement du programme de bon usage des antimicrobiens (ASP). Les ICP doivent être déterminés et communiqués à la direction de l'hôpital et aux autres parties prenantes clés.1,2 Ce chapitre décrit des objectifs de l’ASP et les ICP les plus courants utilisés afin d’évaluer les performances de l'ASP dans les hôpitaux de l’Afrique et du Moyen-Orient en matière des conditions d'utilisation d’antibiotiques, des coûts, des résultats cliniques et de l'impact de la résistance aux antimicrobiens (RAM) (tableau 1). Il décrit également le cadre pour le suivi de l’évolution des ICP.
Tableau 1
| Mesures des processus | Mesures des résultats |
|---|---|
|
Consommation d'antibiotiques
Respect des recommandations
|
Résistance aux antimicrobiens (RAM)
Clinique
Économie
|
aAdaptation du tableau d'Akpan MR, et al.Antibiotiques(Bâle).2016;5(1):5;
bStandardisé à 1000 jours-patients.
CRAB, acinetobacter baumannii résistant aux carbapénèmes; CRE, Enterobactérie résistante aux carbapénèmes;
CRPA, Pseudomonas aeruginosa résistant aux carbapénèmes;BLSE, β-lactamase à spectre étendu; SARM,
Staphylococcus aureus résistant à la méthicilline
Comme indiqué dans le tableau 1, les ICP sont classés en deux catégories principales2:
- Mesures des processus, y compris les mesures quantitatives et qualitatives de l'utilisation d'antibiotiques
- Mesures des résultats, y compris les mesures des résultats microbiologiques, cliniques et économiques
Une combinaison de mesures des processus et des résultats doit être choisie pour évaluer l'impact des interventions ASP.2 Certaines des mesures les plus couramment utilisées sont décrites ci-dessous.
Résultats de la consommation d’antibiotiques
Dans la mesure du possible, tous les ASP doivent effectuer des mesures de la consommation d'antibiotiques en utilisant des jours de traitement (DOT) ou des doses quotidiennes définies (DDD),6généralement standardisées pour 1000 jours-patients.5 La durée du traitement (LOT) est également un paramètre utile d'utilisation d'antibiotiques.5,9

aProfesseur Adrian Brink et Docteur Ali Omrani, avis d'expert
Dose Définie Journalières (DDD, Defined Daily Doses)
La DDD est un paramètre couramment utilisé pour mesurer la consommation d'antibiotiques.6 La DDD est calculée en prenant la quantité totale (g) d'un antibiotique acheté, dispensé ou administré, et en la divisant par la DDD définie par l'Organisation mondiale de la Santé (OMS) (dose quotidienne moyenne supposée d'un médicament pour son indication principale chez un adulte ayant une fonction rénale normale) .6 La plupart des pharmacies hospitalières disposent d'un moyen de calculer la quantité de tout antibiotique prescrit ou dispensé ;6 l'OMS publie aussi les valeurs DDD des antibiotiques (www.whocc.no/atc_ddd_index). La DDD est donc souvent un moyen plus simple de mesurer les ICP pour les ASP dans les hôpitaux dont les pharmacies ne peuvent pas calculer les DOT. Bien qu'elle soit moins précise que les DOT et qu’elle ne s'applique pas aux patients pédiatriques, la DDD est une mesure utile de la progression de l'ASP à condition de rester cohérent dans l'utilisation de la méthodologie au fil du temps.6

aNombre de jours-lits occupés en 30 jours.
Jours de Traitement (DOT, Days of Therapy)
Les DOT (le nombre de jours pendant lesquels un patient reçoit au moins une dose d'antibiotique, ajouté pour chaque antibiotique) est la mesure préférée de la consommation d'antibiotiques dans de nombreux hôpitaux.7 Cependant, de nombreux hôpitaux ne sont pas en mesure de calculer facilement les DOT, car cela nécessite des données au niveau du patient, idéalement issues de dossiers médicaux électroniques.11 Les hôpitaux dépourvus de dossiers médicaux électroniques et de logiciel d'exploration de données peuvent compter manuellement les DOT pour les antibiotiques ciblés dans des établissements hospitaliers ou des populations de patients spécifiques.11

aLe nombre de jours pendant lesquels le patient reçoit plusieurs antibiotiques correspond à la somme des jours pour chaque antibiotique.
Durée du traitement (LOT, Length of therapy)
La “LOT” (le nombre de jours pendant lesquels un patient reçoit une antibiothérapie, quel que soit le nombre d'antibiotiques administrés) fournit une évaluation précise de la durée réelle de l'antibiothérapie par chaque patient sorti de l’hôpital.9 La LOT diffère de la DOT en ce que le nombre d'antibiotiques n'est pas pertinent et qu’il tient compte des intervalles de dosage supérieurs à 24 heures.9 La LOT peut être utilisée avec les DOT pour estimer la fréquence de l'antibiothérapie combinée9,10
- DOT/LOT = 1 indique une monothérapie
- DOT/LOT > 1 indique un traitement combiné

aSi le patient reçoit plusieurs antibiotiques par jour, cela compte comme 1 jour.
Respect des recommandations (résultats)
Lorsqu'un programme AMS met en œuvre des recommandations de traitement antibiotique spécifiques à l'hôpital, l'adhésion à la prescription doit être évaluée en mesurant le niveau de conformité aux directives.7 L'évaluation de l'adhésion doit permettre de dire si le bon agent, avec le spectre approprié d'activité pour traiter une infection spécifique, a été prescrit à la bonne dose, la bonne voie, en temps opportun et pour la durée appropriée.7 Le nombre d'interventions AMS effectuées et le niveau d'acceptation des interventions ASP (par exemple, le nombre de recommandations d'audit prospectif formulées et le pourcentage accepté) en sont d'autres ICP couramment utilisés qui renseignent sur la pertinence de la prescription.2
La désescalade est une autre stratégie de surveillance de l'utilisation des antimicrobiens.13 Son
objectif est de réduire le spectre antibiotique sur la base d'une culture positive, d'arrêter les prescriptions d'antibiotiques inutiles et de limiter la durée du traitement en cas de réponse clinique rapide.13 La désescalade a été associée à une diminution de la résistance bactérienne et à de meilleurs résultats que chez les patients sans passage au spectre plus étroit, et il s'agit d'une approche sûre pour les patients des unités de soins intensifs (USI).13 Inversement, l’antibioprophylaxie en chirurgie est une autre façon de mesurer l'utilisation des antimicrobiens. Elle doit se concentrer sur la sélection du bon antibiotique pour la procédure, le bon moment de la perfusion de l'antibiotique et le moment approprié pour arrêter le traitement antibiotique.14

aAdaptation de Barlam TF, et al.Clin Infect Dis. 2016;62(10):e51-e77;
bLe bon antibiotique, la bonne posologie et la bonne voie.

aAdaptation de Cuesta D, et al. Rev Chilena Infectol. 2019;36 (1) :9-15 et Bratzler DW et Houck PM.
Clin Infect Dis. 2004;38 (12) :1706-15;
cLe bon antibiotique, le bon moment d'administration (15 à 60 minutes avant l'intervention) et l'arrêt approprié de l'antibiotique après l'intervention.
Résultats de la résistance aux antimicrobiens (RAM)
La prévention de la RAM est l'un des principaux objectifs de l'AMS. Il est donc important de mesurer la RAM autant que possible dans le cadre des programmes AMS.8 Il est important d'avoir accès à la base de données microbiologique de la RAM sur une base mensuelle ou trimestrielle ou compter manuellement les cas dans les petits hôpitaux avec de faibles volumes de résistance.12 Lors de l'interprétation des données sur la RAM en relation avec les interventions d’AMS, il est important de reconnaître que le développement et la propagation de résistance est multifactorielle, et qu'il peut s'écouler des années avant que l'impact d'une intervention AMS sur la résistance aux antimicrobiens ne devienne apparent.2,6
Au niveau du patient, la mesure de la résistance aux antimicrobiens sert à renseigner sur des agents pathogènes bactériens sélectionnés et est axée sur les populations de patients recevant une intervention AMS ciblée (par exemple, le pourcentage de patients atteints des infections aux Pseudomonas aeruginosa résistant aux carbapénèmes dans une unité de soins intensifs avec utilisation restreinte de carbapénèmes).6,7 Il est également possible de mesurer l’évolution dans le temps de l'incidence des profils de résistance par populations bactériennes (par exemple, le nombre total d'isolats d'un mois à l'autre), qu'ils soient ou non liés à une infection, car il est beaucoup plus difficile d'établir le diagnostic d'infection avec une définition standardisée.6

aKlebsiella pneumoniae et Escherichia coli ;
bStaphylococcus aureus (résistant et sensible à la méthicilline) ;
cEntérobactéries résistantes aux carbapénèmes dont Escherichia spp., Klebsiella spp., Enterobacter spp., Morganella spp., Serratia spp., Citrobacter spp., résistantes à l'ertapénem ;
dTous Escherichia spp., Klebsiella spp., Enterobacter spp., Morganella spp. , Serratia spp., Citrobacter spp., résistantes et sensibles à l'ertapénem ;

eLes CRPA sont Pseudomonas aeruginosa résistants au méropénem ou à l'imipénem. Nous recommandons d'utiliser le méropénem comme marqueur ;
fTous les Pseudomonas aeruginosa, résistants et sensibles au méropénem ou à l'imipénem.
*Toutes les formules ont été fournies par le Dr Christian Pallares, avec le soutien scientifique des publications citées.
Résultats cliniques
Durée du séjour (LOS, length of stay)
Les programmes AMS ont le potentiel de réduire la durée de séjour, principalement grâce au passage de la voie IV à la prise orale en temps opportun ou en arrêtant un traitement par voie IV non nécessaire.1,5 Contrairement à d'autres paramètres de résultats cliniques potentiels, tels que le taux de mortalité et de réadmission, les données sur la durée de séjour sont souvent relativement faciles à obtenir. La durée de séjour en unité de soins intensifs peut être utilisée à la place de la durée de séjour à l'hôpital comme mesure de l'amélioration clinique.5 La durée de séjour signifie le nombre de jours pendant lesquels un patient est resté dans un établissement pour patients hospitalisés au cours d'un seul épisode d’hospitalisation.
Les jours de séjour dans un hôpital pour les séjours en hospitalisation sont calculés en soustrayant le jour d'admission du jour de sortie (par exemple, la durée de séjour d'une personne qui entre à l'hôpital en tant que patient hospitalisé et en sort le même jour est 1 jour).11
En règle générale, les jours d'alitement et les sorties temporaires ne sont pas soustraits de la durée totale de séjour d'un patient.5 La durée de séjour moyenne est calculée en divisant la durée de séjour totale pour tous les patients sortis au cours du mois par le nombre de patients sortis au cours du mois. La LOS moyen peut être calculée pour l'ensemble de l'établissement ou par unité/programme de spécialité*.

*Professeur Adrian Brink et Docteur Ali Omrani, avis d'expert
Résultats économiques
Économies réalisées sur les coûts des antibiotiques
Il est important de mesurer l'impact financier de l'ASP.5 La mesure des coûts des antibiotiques peut montrer que le programme AMS permet de réaliser les économies de coûts pour l'hôpital et peut être utilisé pour justifier le soutien continu de la part de la direction de l’établissement pour l'ASP.6Dans la mesure du possible, les coûts des antibiotiques doivent être mesurés à l'aide des ordonnances ou des données d'administration plutôt que des données d'achat.7 Pour calculer les économies de coûts, il faut connaître le coût du traitement en doses avant l'intervention de l'équipe AMS (en supposant que la durée du traitement est calculée avant l’intervention) et en soustraire le coût de traitement actuellement.11 Le produit final correspond aux économies de coûts de l'intervention.5À la fin du mois, il faudra faire un total de tout l'argent économisé grâce aux interventions.5
Sources de consommation d'antibiotiques et suivi de l'utilisation8
- Doses achetées : bien que facile à obtenir, cette donnée est la moins précise quand il s’agit de la véritable utilisation d'antibiotiques
- Doses dispensées : relativement faciles à obtenir et permettent de lier l'utilisation au patient et au nombre de jours. Toutefois, il existe un risque de surestimer l'utilisation d'antibiotiques en incluant les doses gaspillées et manquantes
- Doses administrées : c’est la façon la plus précise de calculer la véritable utilisation de antibiotiques pour le patient et le temps, cependant c’est la plus difficile à obtenir, car elle repose sur la tenue précise/ l'utilisation de dossiers médicaux électroniques)
Lors du suivi des ICP dans le cadre des programmes AMS, il convient de:
- Se concentrer sur les antibiotiques les plus communs, les agents pathogènes multirésistants, les populations de patients et les établissements hospitaliers les plus susceptibles d'être touchés par les interventions du programme AMS8
- Créer des graphiques montrant l’évolution des tendances des ICP dans le temps, idéalement à l’échelle d’un mois ou d’un trimestre8
- Comparer les données obtenues après la mise en œuvre du programme AMS avec des données avant la mise en œuvre8
Si un antibiotique est un usage restreint, un autre peut être utilisé à sa place, ce qui n'entraîne aucun changement net dans l'utilisation des antibiotiques (ce que l'on appelle « serrer le bout du ballon »).12 En plus de surveiller les antibiotiques individuels, le suivi des classes d'antibiotiques clés permet d’avoir l'image la plus claire de la consommation globale d'antibiotiques (Figure 1).
Comme c'est le cas pour la résistance aux antimicrobiens, la consommation totale d'antibiotiques et les coûts peuvent nécessiter plus d'un an pour que des changements soient visibles par rapport au niveau de référence du programme pré-AMS.2
Figure 1
jours-patients dans le temps, et un exemple du « serrage du bout du ballon »(diminution de la consommation de carbapénèmes avec une augmentation de la consommation de céphalosporines et d'aminoglycosides en juillet-septembre 2016, n'entraînant aucun changement dans la consommation globale d'antibiotiques par rapport à janvier-mars 2016)12
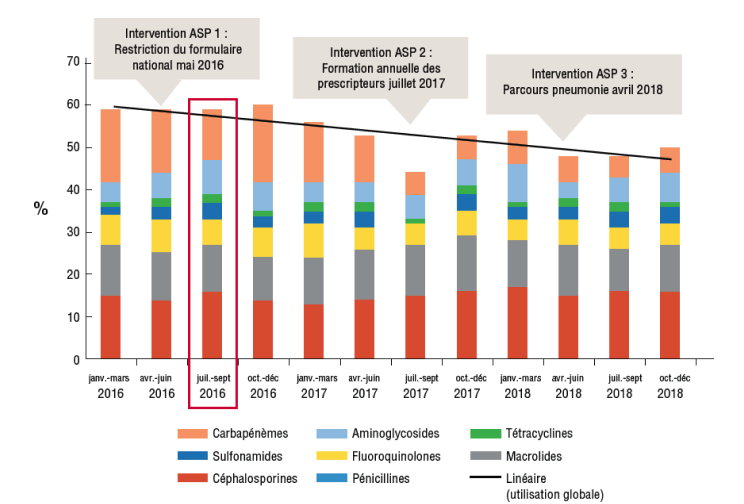
ASP, antimicrobial stewardship program (programme de bon usage des antimicrobiens ) ;DOT, days of therapy (jours de thérapie)
Il peut être utile de représenter la consommation d'antibiotiques et les données de coût pour des antibiotiques individuels ou des classes d'antibiotiques sur le même graphique afin de mettre en évidence et expliquer les écarts. Par exemple, la (Figure 2) montre qu’à deux exceptions près, les variations de consommation et de coûts sont assez proportionnelles. Les augmentations ou les diminutions des coûts qui ne sont pas proportionnelles à l'utilisation reflètent généralement des changements au niveau des prix d'achat des antibiotiques ou des doses recommandées.8
Figure 2
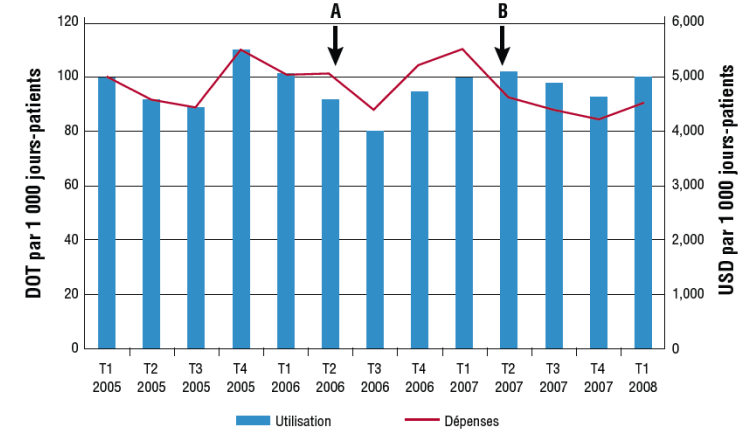
DOT, jours de thérapie ; T, trimestre
Lors du suivi et du reporting sur l’évolution des ICP dans le temps, il est important de reconnaître que les réductions initiales de la consommation et des coûts des antibiotiques ciblés par les interventions du programme AMS ont tendance à se tasser au fil du temps.2 Pour illustrer le fait que les programmes AMS continuent à procurer des bénéfices même lorsque les ICP restent stables ou semblent baisser avec le temps,2,8 il est important de créer des graphiques pour montrer les données réelles après la mise en œuvre des interventions du programme AMS par rapport à la tendance pré-programme projetée à partir des données de base (Figure 3).
Figure 3
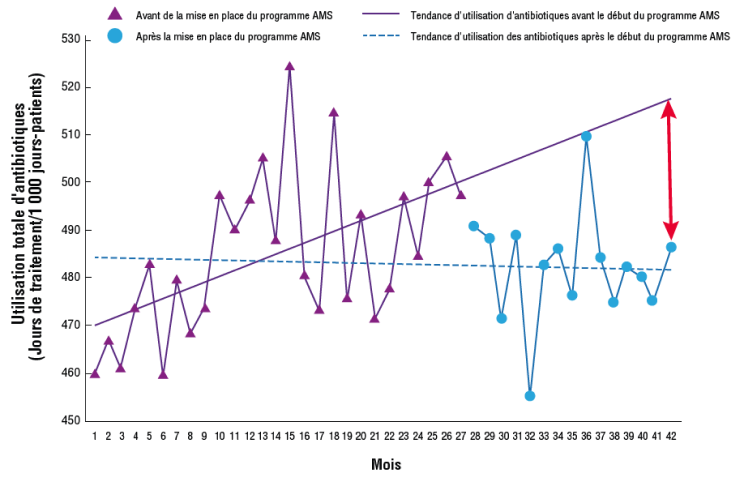
Bon usage des antimicrobiens (AMS, microbial stewardship)
Adaptation de Patel D et MacDougall C. Hosp Pharm.
Le groupe Access (accéder) se compose du premier et du deuxième choix pour le traitement empirique des syndromes infectieux les plus courants, ce sont des antibiotiques qui devraient toujours être largement disponibles dans le monde. Le groupe Watch (surveiller) comprend les classes d'antibiotiques considérées comme ayant des problèmes de toxicité et/ou un potentiel de résistance plus élevés. Le groupe Reserve (réserver) comprend de nouveaux antibiotiques et options de traitement réservés aux infections complexes ou aux cas impliquant de multirésistance. Cette catégorie comprend les antibiotiques de « dernier recours » dont l'utilisation doit être réservée aux milieux spécialisés et aux cas spécifiques où les traitements alternatifs ont échoué.4,15,16
L'idée étant que les programmes de gouvernance accordent la priorité à l'utilisation d'antibiotiques de premier et de deuxième choix empirique dans les hôpitaux (c'est-à-dire ceux du groupe Access), surveillent l'utilisation des antibiotiques Watch, et réduisent au minimum l'utilisation d'antibiotiques Reserve. L'un ou l'autre pourrait être utilisé comme indicateur clé de performance à l'hôpital ou au niveau national, par exemple, la consommation de Watch (y compris les carbapénèmes) pourrait être surveillée chaque année.15
Des exemples de la manière dont la catégorisation AWaRe peut être utilisée comme indicateur de performance clé pour la consommation d'antibiotiques en Afrique et au Moyen-Orient sont présentés dans les figures 4a et 4b.4
Figure 4a
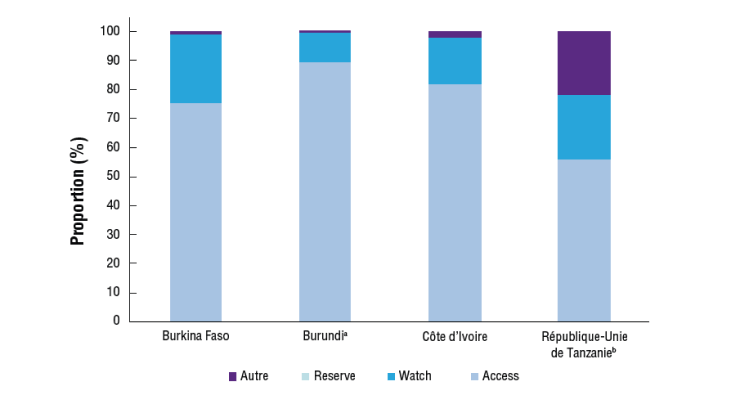
aCe rapport ne concerne que le secteur public ;
bDonnées de 2016.
AWaRe, Access, Watch, and Reserve
Figure 4b
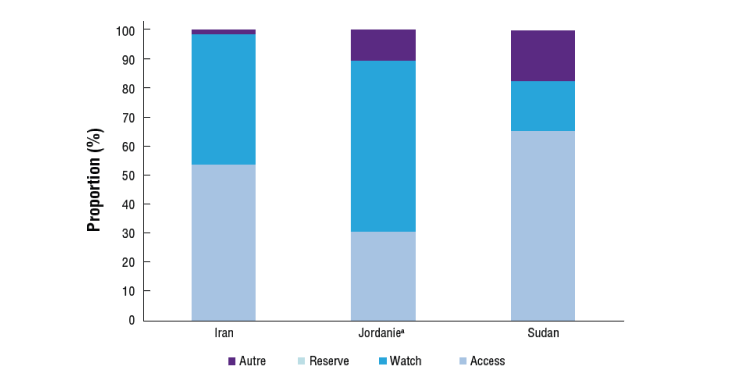
aCouverture de la consommation d'antimicrobiens estimée à 70%, non ajustée en fonction de la population.AWaRe, Access, Watch, and Reserve
Divers outils d'aide à l'utilisation des ICP ont été fournis par différentes organisations et peuvent être trouvés en ligne:
- Antimicrobial Consumption (AMC) Tool est un outil informatique de consommation des antibiotiques qui transforme en DDD les données de consommation d'antibiotiques fournies sous forme de nombre de conditionnements. Cet outil est disponible sur: amu-tools.org/amctool/amctool.html
- Un guide détaillé sur la façon de calculer les DDD d’antimicrobiens et les DDD pour 1 000 jours-patients à l'aide des données de votre rapport sur l’utilisation d'antimicrobiens, les valeurs DDDapprouvées par l'OMS (www.whocc.no/atc_ddd_index)
- Des exemples de calculs de ICP, y compris les taux DOT, DDD, LOT et AMR, peuvent être trouvés sur: primer-antimicrobial-stewardship-ltc.pdf (publichealthontario.ca)
- Un kit à outils pratique de l'OMS qui fournit des conseils sur la mise en oeuvre de l'AMS dans les pays à faibles ressources est disponible sur: https://www.who.int/publications/i/item/9789241515481
- Doron S and Davidson LE. Antimicrobial stewardship. MayoClinProc. 2011;86(11):1113–23.
- Patel D and Macdougall C. How to make antimicrobial stewardship work: practical considerationsfor hospitals of all sizes. Hosp Pharm. 2010;45(Suppl. 11):10–21.
- Akpan MR, Ahmad R, Shebl NA, Ashiru-Oredope D. A review of quality measures for assessing the impact of antimicrobial stewardship programs in hospitals. Antibiot Basel Switz. 2016;5(1):5.
- World Health Organization. WHO report on surveillance of antibiotic consumption:2016–2018 early implementation. 2018. Available at:https://www.who.int/publications/i/item/9789241514880 Consulté en août 2021.
- Morris AM. Antimicrobial stewardship programs: Appropriate measures and metrics to study their impact. Curr Treat Options Infect Dis. 2014;6(2):101–12.
- Barlam TF, Cosgrove SE, Abbo LM, MacDougall C, Schuetz AN, Septimus EJ, et al. Implementing an antibiotic stewardship program: Guidelines by the Infectious Diseases Society of America andthe Society for Healthcare Epidemiology of America. Clin Infect Dis. 2016;62(10):e51–e77.
- Centers for Disease Control and Prevention. Core elements of hospital antibiotic stewardshipprograms. 2014. Available at: https://www.cdc.gov/antibiotic-use/healthcare/pdfs/coreelements.pdf Consulté en avril 2020.
- The Joint Commission. Antimicrobial stewardship toolkit. 2013. Available at: www.jcrinc.com/antimicrobial-stewardship-toolkit Consulté en avril 2020.
- Polk RE, Hohmann SF, Medvedev S, Ibrahim O. Benchmarking risk-adjusted adult antibacterial drug use in 70 US academic medical center hospitals. Clin Infect Dis. 2011;53(11):1100–10.
- Centers for Disease Control and Prevention. Determining patient days for summary data collection: Observation vs. inpatients. Available at:www.cdc.gov/nhsn/PDFs/PatientDay_SumData_Guide.pdf Consulté en avril 2020.
- Public Health Ontario. Antimicrobial stewardship programs (ASPs) – Metrics examples. Available at: www.publichealthontario.ca/en/eRepository/ASP_Metrics_Examples.pdf Consulté en avril 2020.
- Moran J, D’Angeli M, Kauber K. Jump start stewardship: implementing antimicrobial stewardship in a small, rural hospital. 2016. Available at: www.cdc.gov/getsmart/community/~local/modules/programs-measurement/Stewardship-in-Small-Rural-Hospitals-Workbook-WA-508.pdf Consulté en avril 2020.
- Cuesta DP, Blanco VM, Vallejo ME, Hernández-Gómez C, Maya JJ, Motoa G, et al. Impacto clínicodel desescalamiento a ertapenem en pacientes críticos con infecciones por Enterobacteriaceae. Rev Chil Infectol. 2019;36(1):9–15.
- Bratzler DW and Houck PM. Antimicrobial prophylaxis for surgery: an advisory statement from the National Surgical Infection Prevention Project. Clin Infect. 2004;38(12):1706–15.
- Budd E, Cramp E, Sharland M, Hand K, Howard P, Wilson P, et al. Adaption of the WHO Essential Medicines List for national antibiotic stewardship policy in England being AWaRe. J Antimicrob Chemother. 2019;74(11):3384–9.
- Brink AJ and Mendelson M. Be AWaRe: new metrics for paediatric antibiotic stewardship. Lancet Infect Dis. 2019;19(1):6–7.
Il est entièrement gratuit de télécharger instantanément des matériels ou de les faire poster pour vous par l'intermédiaire de notre service de commande par correspondance.