Guide de mise en œuvre des programmes ‘Antimicrobial Stewardship’ de bon usage des antimicrobiens dans les hôpitaux en Afrique et au Moyen-Orient
Ce guide est destiné à fournir des conseils pratiques et détaillés pour la mise en œuvre des programmes de bonne gestion des antimicrobiens « Antimicrobial stewardship » (AMS) dans les hôpitaux d'Afrique et de Moyen-Orient aux responsables des programmes AMS. Les informations contenues dans ce guide sont conformes aux recommandations d'organisations réputées et reconnues à l'échelle internationale, principalement les Centres pour le Contrôle et la Prévention des maladies (CDC) des États-Unis, les Centres africains de contrôle et de prévention des maladies (Africa CDC), La société américaine des maladies infectieuses (Infectious Diseases Society of America)/Society for Healthcare Epidemiology of America (SHEA) et l’Organisation mondiale de la Santé (OMS)1–5.
De nombreuses ressources utiles pour AMS ont été mises à disposition en ligne avec un accès libre. Un tableau contenant les liens vers les recommandations et le kit d’outils pour la mise en œuvre des programmes AMS sont fournis dans l'annexe1.
Afin de définir de manière réaliste des objectifs du plus simple au plus complexe, selon la situation et le contexte dans l’hôpital, on présentera les fonctions et les responsabilités de l'équipe centrale AMS, ainsi que les indicateurs de résultats/attentes en fonction de la maturité du programme AMS.
Les étapes clés pour la mise en œuvre d'un programme AMS
- L’accomplissement des huit étapes clés décrites dans ce guide garantira que votre programme comporte les sept éléments essentiels des programmes AMS hospitaliers, tel que recommandé par le CDC en 2019 (Figure 1).2,6
Figure 1
L’accomplissement des huit étapes clés décrites dans ce guide garantira que votre programme comporte les sept éléments essentiels des programmes AMS hospitaliers, tel que recommandé par le CDC en 2019.2,a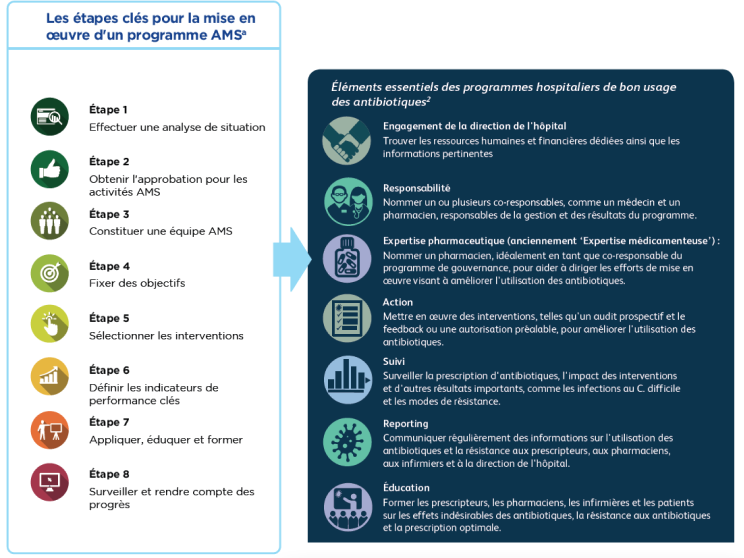
Étape 1 : Analyse de la situation
L'une des premières étapes vers la mise en œuvre d'un programme AMS consiste à comprendre quelles politiques, ressources et systèmes sont déjà en place pour optimiser l'utilisation des antibiotiques et soutenir les activités AMS.7 Utilisez cette liste de contrôle AMS pour voir l’état d’avancement de votre hôpital.
Étape 2 : Obtenir l'approbation pour les activités AMS
Obtenir l'approbation pour les activités AMS, le soutien officiel et le financement pour les activités AMS de la part de l'administration de l’hôpital est une étape cruciale, mais qui peut être difficile à obtenir en raison de la compétition pour les ressources.8 Il est donc important de fournir à la direction de l'hôpital une analyse de rentabilisation crédible pour les persuader que le financement d'un programme AMS aura des avantages pour l'hôpital.9
Pour 100 lits, il a été suggéré que ≥10 heures du temps pharmacien et 3.5 heures du temps du clinicien devrait être dédié aux activités AMS par semaine10
Tâchez d’obtenir :
- L’engagement en temps et en rémunération appropriés pour les prestataires AMS en fonction de la taille de l'hôpital10
- Le soutien pour les maladies infectieuses (MI) ou l'engagement clinique, y compris la formation et l'éducation AMS pour les travailleurs de la santé10
- Des services de microbiologie et de technologie de l'information (TI) adéquats pour soutenir les activités AMS11
Quelques idées pour développer l’analyse de rentabilisation :
- Soulignez l'importance d'une utilisation prudente des antibiotiques pour le patient, l'hôpital et la société1,2
- Évoquez toute réglementation nationale concernant la mise en œuvre des programmes AMS et les déclarations sur l'importance des programmes AMS venant des institutions reconnues par l'administration hospitalière, tels que le CDC1,2
- Décrivez les problèmes de résistance aux antimicrobiens (RAM) au sein de l'hôpital à l'aide des données recueillies à partir de votre antibiogramme ou ceux des hôpitaux locaux/régionaux, si les données spécifiques à l'hôpital ne sont pas disponibles12–14
- L'administration judicieuse et au bon moment des antimicrobiens fait partie des stratégies de sécurité des patients
Les données du programme de surveillance ATLAS 2015-2018 pour l'Afrique et le Moyen-Orient ont révélé la multirésistance dans 25 à 36 % des cas des entérobactéries et des isolats de P. aeruginosa.15
- Expliquez les processus qui conduisent à une utilisation optimale des antibiotiques (Figure 2)16
- Décrivez le but et les avantages avérés des programmes AMS1,17-21
- Faites appel aux publications pour décrire les programmes AMS mis en place avec succès dans des hôpitaux similaires de la région (il peut s’agir des initiatives ciblées spécifiques à une unité ou des approches globales à l'échelle de l'hôpital)18,22–30
Il existe de plus en plus de preuves démontrant les bénéfices économiques (en terme de coût efficacité) des programmes AMS en milieu hospitalier.1,17,19,20
- Expliquez que les économies réalisées grâce au programme AMS compenseront les coûts7,8,14,31,32
- Proposez les moyens les plus efficaces pour mettre en œuvre le changement en utilisant les ressources existantes9
- Proposez des projets pilotes faciles ou peu coûteux (voir l’étape 5), en se concentrant sur un ou quelques antibiotiques ou types d'infection dans une à deux unités hospitalières, avec des plans d'expansion en cas de succès démontré13
Le bon usage des antimicrobiens (AMS) dans les hôpitaux :En Afrique et au Moyen-Orient, de nombreux établissements de santé ont mis en place des programmes de bon usage des antimicrobiens (ASP, antimicrobial stewardship programs).1,2 Bien que des expériences réussies de ASP (Antimicrobial Stewardship Program) aient été publiées dans ces régions, il n'y a à ce jour que peu de rapports sur les impacts cliniques, microbiologiques, économiques et autres mesures de résultats de ces interventions3, puisque la plupart des études disponibles se concentrent sur la consommation d'antimicrobiens dans un seul centre ou un seul service (principalement des unités de soins intensifs). Cependant, des mesures de résultats telles que la durée du séjour et les taux de résistance aux antibiotiques, Clostridioides difficile et les infections nosocomiales ont récemment été reportées en Jordanie, Liban, Palestine, Qatar, Arabie saoudite et Émirats arabes unis.2,4
Une revue systématique récente des ASP comprenait 20 études provenant de l'Arabie saoudite, du Qatar, du Liban et de la Jordanie, ainsi qu'une étude provenant de la Palestine ainsi que des Émirats arabes unis.
Cela a démontré que la mise en œuvre de tels programmes était associée à une amélioration des taux de sensibilité et à une diminution de l'utilisation globale des antimicrobiens.2 Par exemple, les interventions de bon usage des antimicrobiens (AMS) en Arabie saoudite étaient associées à une meilleure adhésion aux recommandations de prescription des antimicrobiens, à un meilleur moment de l'initiation et le choix d'un traitement antimicrobien empirique ainsi que la réduction des taux d'infection à Clostridioides difficile.4
De même, en Afrique du Sud, une intervention de l’antibioprophylaxie peri-opératoire dans 34 hôpitaux a démontré que l'amélioration des mesures antibiotiques péri-opératoires (choix du médicament, de la dose, du moment et de la durée) peut être réalisée en toute sécurité et permet, par ailleurs, de réduire considérablement les infections du site opératoire.5 En outre, des mesures de résultats telles que la mortalité, les taux de réadmission et le temps d’attente (délai entre la prescription et la perfusion) ont également été documentées dans des ASP réussies dans d'autres pays africains tels que le Kenya, le Soudan, Tanzanie et Égypte.1
1 Akpan MR, Isemin NU, Udoh AE, Ashiru-Oredope D. Implementation of antimicrobial stewardship in African countries: a systemic literature review. J Glob Antimicrobial Resist.2020 ; 22 : 317–24.
2Ababneh MA, Nasser SA, Rababa’h AM. A systematic review of Antimicrobial Stewardship Program implementation in Middle Eastern countries. Int J Infect Dis. 2021 ; 105 : 746–52.
3Lévy GH. Gestion responsable des antimicrobiens dans les hôpitaux : fonctionne-t-elle et pouvons-nous le faire ? J Glob Résistance aux antimicrobiens. 2014 ; 2(1) : 1–6.
4Nasr Z, Pravatti B, Wilby KJ. The impact of antimicrobial stewardship strategies on antibiotic appropriateness and prescribing behaviours in selected countries in the Middle East: a systematic review. East Mediterr Health J. 2017 ; 23 (6) : 430-40.
5Brink AJ, Messina AP, Feldman C, Richards GA, van den Bergh D. From guidelines to practice: a pharmacist-driven prospective audit and feedback improvement model for peri-operative antibiotic prophylaxis in 34 South African hospitals. J Antimicrob Chemother. 2017 ; 72 (4) : 1227-34.
Figure 2
Exemple de diagramme des moteurs de l’AMS16,b
Étape 3 : Constituer une équipe AMS
Respectez le budget et les contraintes de personnel de l'hôpital pour créer l'équipe AMS multidisciplinaire la plus efficace disponible (Figure 3).7,9,28
Bien que l’AMS ne possède pas de structure d'équipe dédiée, l'équipe aura besoin d'un leader engagé et influent ayant le pouvoir d'effectuer des changements (voir le guide de leadership et de communication dans ce kit d’outils).33 Le chef d'équipe AMS idéal doit être un médecin spécialisé en MI ou un microbiologiste clinique (MC), assisté d'un pharmacien clinicien.1,2 À défaut de disposer d’un spécialiste en MI ou MC, le chef d'équipe peut être un clinicien d'une autre spécialité intéressé par le projet ou un pharmacien clinicien.9 En Afrique et au Moyen-Orient, de nombreux ASP sont dirigés par des pharmaciens, qu'ils soient spécialisés ou non. Un microbiologiste clinique ou des spécialistes du contrôle des infections qui possèdent une bonne compréhension de nombreuses questions pertinentes, représenteraient une suite logique du choix de leadership. Vous pouvez également solliciter le conseil d’un spécialiste externe en MI et une formation auprès d'un hôpital ayant des moyens plus importants pour être plus à même de soutenir l'équipe AMS locale.28,30
Une collaboration étroite avec le laboratoire de microbiologie, le contrôle des infections et le personnel informatique sont particulièrement utiles pour un programme AMS bien rôdé.7 Sous réserve de disponibilité, les membres principaux de l'équipe AMS doivent donc inclure des microbiologistes cliniques, des experts en contrôle des infections et des experts en informatique.9,34
Il convient également d'inclure des membres de l'administration hospitalière, des prescripteurs de première ligne et des infirmiers afin d’encourager une large acceptation du programme.2 En général, les membres de l'équipe AMS et le personnel de soutien peuvent être recrutés parmi les praticiens intéressés par le projet au sein de votre hôpital.7
Une fois que les rôles et les responsabilités de chaque membre de l'équipe ont été clairement définis (tableau 1), l'équipe commence à travailler sur les étapes 4 à 8.
Figure 3
Structure recommandée de l'équipe hospitalière d’AMS34,b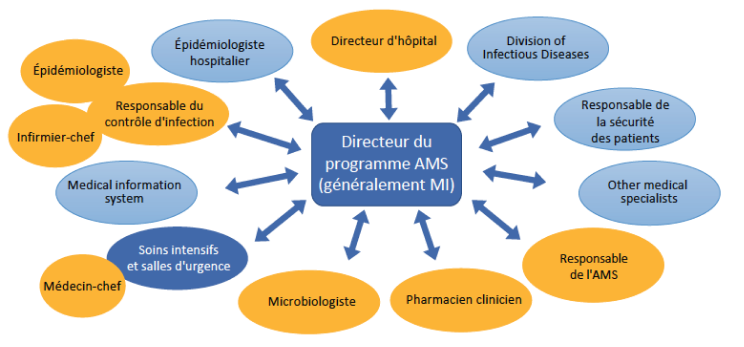
Tableau 1
Rôles et responsabilités recommandées pour les membres de l'équipe centrale AMS
a
| Membre de l équipe
|
Rôle
|
Responsabilités
|
Spécialiste en MI, microbiologiste clinique ou pharmacien
|
Chef d'équipe
|
- Établir le leadership pour la conception et la mise en œuvre de l'AMS
- Produire des recommandations antimicrobiennes
- Aboutir à un consensus et la communication des
recommandations antimicrobiennes auprès des
différents spécialistes avant leur mise en œuvre
- Définir l'évaluation du programme avec l'épidémiologiste et la personne affectée à l'AMS
- Former et accompagner la personne affectée au
programme AMS jusqu'à son acceptation par
l'équipe des médecins de l'établissement
- Coordonner les activités de l'AMS entre la
personne affectée à l'AMS, le pharmacien, le
microbiologiste clinique, l'épidémiologiste
hospitalier et le personnel d’administration pour
le succès de l'AMS
|
Médecin généraliste, médecin-interniste ou docteur en pharmacie
|
|
- Doit être formé à la résistance aux
antimicrobiens, à la thérapie antimicrobienne et
aux rapports de microbiologie afin d’assurer le
respect des recommandations
- Doit en permanence faire le relais entre le
laboratoire de microbiologie, le médecin traitant
et le patient
- Mettre en œuvre le programme AMS :
l’interaction avec les médecins qui prescrivent
les antibiotiques et le rapport hebdomadaire ou
mensuel de leurs interventions (respect des recommandations antimicrobiennes)
- Disponibilité pour former aux principes et aux
pratiques du programme AMS et les appliquer
|
Épidémiologiste
hospitalier
|
|
- Adapter les recommandations cliniques en
fonction de leur source, du niveau des preuves,
de la périodicité de leur révision et mesurer le
niveau d'adhésion à celles-ci
- Développer des indicateurs (outils métriques)
pour suivre la réalisation des objectifs de l'AMS
et assurer la qualité de ces indicateurs
- Renforcer l’ensemble de stratégies dans la
prévention et le contrôle de la transmission des
micro-organismes à résistance multiple pour
atteindre l'impact attendu
|
Microbiologiste
clinique
|
Chef d'équipe
au laboratoire de
microbiologie
|
- Mettre en place l'antibiogramme, y compris la ventilation par domaines cliniques, en utilisant des notes de bas de page ou des règles de suppression qui aideront les médecins à sélectionner le meilleur antibiotique pour une bactérie donnée (en consensus avec le groupe AMS et l'équipe MI).
- Fournir des informations à jour sur la résistance
aux antimicrobiens dans les différentes unités de
l'hôpital
- Faire le rapport semestriel sur WHONET pour
évaluer la pertinence des recommandations
antimicrobiennes ou toute autre source
pertinente utilisée par l'hôpital
- Utiliser de nouveaux équipements/méthodes
de diagnostic qui fournissent un diagnostic
rapide, sensible et spécifique pour la mise en
œuvre de l'AMS (Bonne gestion (Stewardship) diagnostique)
|
Pharmacien
|
|
- Doit être formé à l'utilisation appropriée des
antimicrobiens, de l'antibiogramme et des
mécanismes de résistance
- Contribuer à l'optimisation de la thérapie
empirique et dirigée, du point de vue de la
pharmacodynamique et de la
pharmacocinétique, avec la remontée
d’information aux médecins
- Soutenir et/ou réaliser des activités qui
permettent de réduire les coûts : par exemple,
passage de la perfusion à l'oral, dosage adéquat,
durée du traitement et notification au médecin
traitant concernant plusieurs spectres de
médicaments pouvant être superposés dans le
cas du même patient
- L'intégration du pharmacien à l'équipe AMS permettra également de planifier l'achat des antimicrobiens en fonction des recommandations en matière des antimicrobiens de l'établissement
|
Praticien de
contrôle des infections
|
Soutien au
contrôle des
infections
|
- Surveillance et notification des flambées d'infections nosocomiales et de résistance
- Formation au contrôle actif des infections
- Mettre en œuvre et surveiller toutes les
précautions selon le type d'infection
|
Expert en
informatique
|
Support
Informatique
|
Développer, mettre en œuvre et maintenir des systèmes informatisés pour soutenir le programme AMS, pour assurer y compris :
- la collecte et l’analyse de données (si possible, à l'aide de dossiers médicaux électroniques et d'une saisie informatisée des ordonnances médicales)
- les alertes (par exemple, arrêts sur les
ordonnances d'antibiotiques nécessitant une
revue ; rappels pour revue des ordonnances)
- Les outils du système d'aide à la décision clinique
|
Étape 4 : Fixer des objectifs
Fixez des objectifs réalistes en fonction des résultats de l'analyse de la situation (voir étape 1).
L'objectif principal de l'AMS est d'encourager l'utilisation optimale des antibiotiques, améliorant ainsi les résultats pour les patients et réduisant les effets indésirables des antibiotiques, y compris la résistance aux antimicrobiens.1 Bien que on s'attende à ce qu'un programme AMS réduise les coûts associés à l'utilisation inappropriée des antibiotiques, l'objectif principal du programme ne doit pas consister à réduire les achats et les coûts de médicaments.34
Les objectifs peuvent être fixés à différents niveaux, à savoir7,9:
- Unités hospitalières spécifiques (par exemple, l'unité de soins intensifs [USI])
- Syndromes infectieux (p. ex., peau et tissus mous)
- Utilisation de classes spécifiques d'antibiotiques et de bactéries résistantes (par exemple, carbapénèmes et/ou Acinetobacter baumanni résistants aux carbapénèmes)
- Certains antibiotiques par voie IV (p. ex., passage des fluoroquinolones par voie IV aux fluoroquinolones par voie orale)
Les objectifs peuvent ensuite être étendus pour inclure l'ensemble de l'hôpital ou une gamme plus large d'antibiotiques et de bactéries résistantes (par exemple, tous les antibiotiques à large spectre et les bactéries Gram-négatives multirésistantes [MDR]).a La mise en œuvre des programmes AMS avec des mesures efficaces de contrôle des infections augmente la probabilité d'atteindre les objectifs en termes de RAM.24,32
Bien que l'objectif principal des programmes de stewardship est d'améliorer les soins aux patients, de nombreuses études ont montré qu'un programme AMS approprié entraîne des économies de coûts importantes.
Étape 5 : Sélectionner les interventions
ll existe de nombreuses interventions AMS potentielles, dont le nombre ou la combinaison peut être sélectionné en fonction des programmes AMS.1,33 Décidez quelles interventions peuvent permettre d’atteindre les objectifs du programme AMS (voir l'étape 4), quelles sont les plus soutenues par le personnel clinique et peuvent être mises en œuvre en utilisant les ressources disponibles
(voir étape 1). Les guidelines IDSA/SHEA fournissent des recommandations basées sur les preuves pour les interventions d’AMS susceptibles d'aider au processus de prise de décision (tableau 2).1
Si vos objectifs comprennent la diminution de l'utilisation de carbapénèmes ou de tout autre antibiotique à large spectre, mettez en place un système d'audit et/ou de feedback pour atteindre cette réductiona
Si c'est la première fois qu'une équipe met en œuvre un ASP dans les pays à revenu faible et intermédiaire, envisagez des mesures concernant les antibiotiques ' à portée de main’.
L'expression ' à portée de main’ en référence au stewardship veut dire la sélection des cibles les plus accessibles plutôt que la confrontation à des problèmes de gestion plus complexes. Ces cibles incluent :35
- Passage voie IV-orale
- Dosage d'antimicrobiens intraveineux
- Substitutions thérapeutiques
- Restriction de la formulation
- Tableaux de prescription
- Limitation de la durée d'utilisation des antibiotique
- Temps d’attente (temps entre la prescription et la perfusion)
- Utilisation de plusieurs antibiotiques en simultané
- Double couverture antibiotique
- Obtention de cultures avant l'administration d'antibiotiques
Tableau 2
Une sélection d'interventions d’AMS fondées sur des preuves
1,34,b
| Interventions
|
Commentaires et recommandations
|
Interventions essentielles
|
Inclure une ou les deux stratégies dans tous les programmes AMS
|
Autorisation préalable
|
- Certains antibiotiques doivent être approuvés par un médecin AMS
ou un pharmacien avant de pouvoir être prescrits
|
Audit prospectif et feedback
|
- Les prescriptions des antibiotiques ayant fait l’objet d’une vérification
(audit) sont examinées par un pharmacien clinicien ou un médecin
spécialiste en MI après le début de l'antibiothérapie, avec le
feedback direct et des recommandations pour continuer, ajuster,
modifier ou arrêter le traitement
|
Interventions
standards
|
Utiliser l'une de ces stratégies en conjonction avec les interventions
essentielles
|
Règles spécifiques à
l'établissement
pour les syndromes infectieux courants |
- Permet de normaliser les pratiques de prescription en fonction des
modèles locaux de résistance aux antimicrobiens, des guidelines
fondées sur les preuves et des facteurs cliniques pertinents
- À utiliser pour orienter et évaluer les choix de traitement empiriques,
la réduction du spectre et de la durée du traitement
|
Passage de la voie
IV à la voie orale
|
- Changer l’administration des antibiotiques avec une bonne
biodisponibilité orale, de la voie intraveineuse à la voie orale dès que
possible
- Stratégie relativement simple et applicable dans de nombreux
contextes
- Intégrer aux activités de routine de la pharmacie
|
désescalade(si
cliniquement
approprié) |
- Changer la thérapie empirique pour un traitement à spectre aussi
étroit que possible dès que possible
- Le choix des antibiotiques pour assurer la réduction du spectre
pendant le traitement empirique peut être basé sur les guidelines de
l'hôpital, tandis que celui du traitement dirigé contre les agents
pathogènes est basé sur les résultats microbiologiques
- Intégrer aux activités de routine de la pharmacie
|
Surveillance
pharmacocinétique
et ajustement
|
- Intégrer dans les activités pharmaceutiques de routine en relation
avec certains agents (c'est-à-dire les aminoglycosides et la vancomycine)
|
Optimisation des doses
|
- Faire des recommandations pour optimiser la dose en fonction des
caractéristiques du patient, du micro-organisme, du site de l'infection
et des principes pharmacocinétiques/ pharmacodynamiques des
agents antibiotiques
- lntégrer aux activités de routine de la pharmacie
|
Interventions
possibles
|
Mettre en œuvre en fonction du niveau de ressources disponibles
|
Test de diagnostic
rapide
|
- Lorsque disponible, utiliser en plus de la culture conventionnelle et
rapports de routine
|
Rapports sur
la sensibilité
sélective
|
- Si elle est mise en œuvre, l'équipe AMS doit la surveiller de près afin
de s'assurer de l’absence des conséquences involontaires
|
Systèmes cliniques
informatisés d'aide
à la décision
|
- La mise en œuvre n’est envisagée que si les ressources
informatiques nécessaires sont facilement disponibles
|
Il est recommandé de baser tous les programmes AMS sur une autorisation préalable ou un audit prospectif ou une combinaison de ces deux stratégies essentielles.1 Les preuves démontrent que l'audit prospectif, le feedback et la préautorisation améliorent l'utilisation des antibiotiques et sont recommandés dans les guidelines comme composants de tout programme de stewardship .1 Les avantages et les inconvénients de chaque stratégie sont décrits dans le tableau 3. Lorsqu'elles sont disponibles, des stratégies assistées par ordinateur doivent être utilisées pour soutenir ces interventions essentielles.1
Tableau 3
Comparaison des stratégies d'autorisation préalable et d'audit prospectif
et du feedback pour les programmes AMS
1,b
| Autorisation préalable
|
Audit prospectif et feedback
|
Avantages
|
|
- Réduit l'initiation d'antibiotiques inutiles /
inappropriés
- Optimise les choix empiriques en fonction
du formulaire et des guidelines de
l'hôpital
- Examen rapide des données cliniques/
cultures antérieures au début du
traitement
- Contrôle directement l'utilisation
d'antibiotiques
- Diminue l'utilisation d'antibiotiques
coûteux
|
- L'interaction directe et le retour
d’information venant des prescripteurs
peuvent accroître la visibilité du
programme AMS et établir des relations
de travail entre l'équipe AMS et les
prescripteurs
- Le feedback peut porter sur le choix
empirique basé sur les guidelines de
l'hôpital ainsi que sur le traitement en aval
(passage de la voie IV à l’administration
par voie orale, réduction du spectre et de
la durée du traitement)
- Un nombre plus important de données
cliniques disponibles pour les
recommandations
- Une plus grande flexibilité dans le temps des recommandations
- La fréquence de l'audit peut être adaptée
en fonction des besoins cliniques et des
ressources (il ne doit pas nécessairement
être effectué quotidiennement si les
ressources sont limitées)
- Préserve l'indépendance du prescripteur
- Offre des avantages éducatifs aux
prescripteurs
|
Inconvénients
|
|
- N'affecte que l'utilisation de certains antibiotiques ciblés
- Influence l'utilisation empirique dans une bien plus grande mesure que l'utilisation en aval (p. ex., réduction du spectre, passage de la voie IV à la prise orale, durée du traitement)
- Perte d'indépendance du prescripteur
- Peut retarder le traitement
- Intensif en ressources en temps réel
- Peut entraîner le passage à d'autres
antibiotiques et sélectionner différents
profils de RAM
|
- Le respect des recommandations issues
du retour d’expérience peut être
volontaire
- En règle générale, chronophage et laborieux, il peut donc être difficile de l'effectuer fréquemment dans des environnements à ressources limitées
- Le succès dépend de la manière dont le feedback est transmis aux prescripteurs
- Des réductions de l'utilisation ciblée d'antibiotiques peuvent prendre plus de temps
|
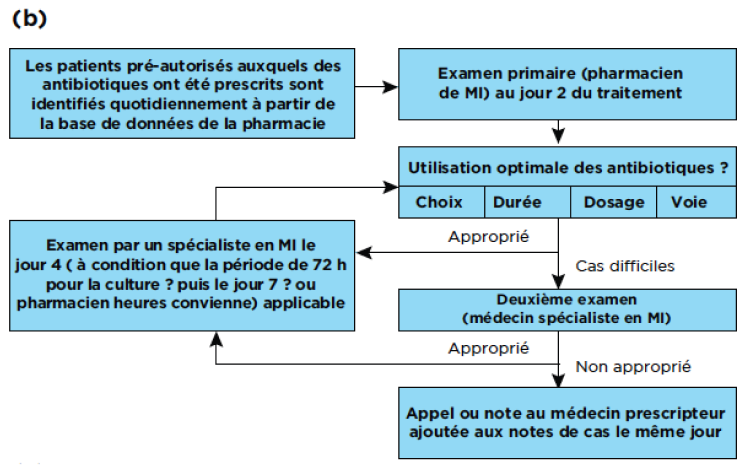
Certaines règles générales doivent être respectées lors de la prise de décision sur la manière d'intégrer les interventions essentielles dans le flux de travail de l'hôpital (Figure 4):
- Visent à revoir les ordonnances dans les 48 heures suivant le début du traitement empirique et une autre fois en fonction des résultats de l'hémoculture (≥72 heures)2
- Si l'approbation des molécules restreintes n'est pas possible au quotidien, 1 à 2 doses peuvent être administrées afin que le traitement ne soit pas retardé, avec une alerte à 48 heures indiquant que le traitement empirique sera interrompu dans les 24 heures si la révision n'est pas effectuée36
Figure 4
Schémas (a) du flux de travail général dans lequel l'approbation ou l' audit d'antibiotiques AMS doit être intégré,37,38,b (b) d’audit prospectif et un système de feedback immédiat, 29,39,b et (c) d’un système d approbation informatisé36,40,b qui pourraient être mis en place dans les hôpitaux d Afrique et du Moyen-Orient

Trois autres interventions fortement recommandées qui peuvent être facilement mises en œuvre en association avec des interventions essentielles sont : 1,32
- Recommandations d'antibiothérapie adaptées à l'antibiogramme hospitalier
- Réduction du spectre
- Passage de la voie IV à l’administration par voie orale
Le passage de la voie IV à l’administration par voie orale et la réduction du spectre, ainsi que la surveillance pharmacocinétique et l'optimisation du schéma posologique, peuvent toutes être intégrées dans les activités de routine de la pharmacie (voir Guide du pharmacien sur le bon usage des antimicrobiensdans les hôpitaux en Afrique et au Moyen-Orient).1Étape 6 : Sélectionner des indicateurs de performance clés
Avant de mettre en œuvre le programme, sélectionnez des paramètres (indicateurs de performance clés [KPI]) pour évaluer l'efficacité du programme AMS par rapport à ses objectifs et ses interventions (tableau 4). Inclure des mesures de performance du processus, telles que la consommation d'antibiotiques, mesurés en tant que dose quotidienne définie (DDD, defined daily dose) ou jours de traitement (DOT, days of therapy) et utilisation appropriée d'antibiotiques, pour confirmer que le programme AMS est bien mis en œuvre.
Envisagez également d'évaluer les retombées, telles que la durée du séjour à l'hôpital (clinique), les tendances de la RAM (microbiologique) et les dépenses en antibiotiques (financières).1,33 Voir le Guide d'utilisation des KPI pour surveiller la progression de l'AMS dans ce kit à outils pour des conseils détaillés sur la sélection, le calcul et le suivi des KPI.
Tableau 4
Une sélection d'indicateurs de performance potentiels pour les
programmes AMS
1,b
| Mesures de processus
|
Mesures des résultats
|
|
Quantité d'antibiotiques utilisés
- DDD
- DOT
- Durée du traitement
|
Microbiologique
- Taux d'infection bactérienne
multirésistante et de colonisation
- Taux d'infection à Clostridioides difficile
|
|
Qualité de l'utilisation des antibiotiques
- Taux de prescription d'antibiotiques
appropriés conformément aux directives
de l’hôpital
- Taux d'acceptation des interventions
- Proportion de patients avec révision
d'antibiotiques sur la base des données
microbiologiques
- Proportion de patients convertis à la
thérapie orale
- Délai de conversion à la thérapie orale
- Proportion de patients passés au spectre
réduit en se basant sur la culture positive
|
Clinique
- Durée du séjour à l'hôpital
- Mortalité liée aux infections
- Taux de réadmission et de réinfection
Financier
- Coût des antibiotiques par patient et par jour
- Coût des antibiotiques par patient et par
admission
|
Étape 7 : Mettre en œuvre, éduquer et former
Élaborez une stratégie de déploiement des interventions. Évitez de faire trop de changements à la fois, introduisez des interventions progressivement à l’échelle d’unité ou de service.2Un programme de restriction ou d’audit de la quinolone et/ou de la ceftriaxone pour l'unité de soins intensifs ou d'autres services endémiques avec des bactéries Gram-négatives productrices de BLSE peut servir de projet initial qui serait mieux accepté qu'une restriction généralisée de la liste des médicaments ou un audit prospectif26
Assurez-vous que les guidelines de traitement et les antibiogrammes hospitaliers sont facilement accessibles. Envisagez l'utilisation de l'intranet, des guides de poche imprimés, des posters de service et des résumés électroniques disponibles aux postes de travail.a
Veiller à ce que les prescripteurs et les autres parties prenantes soient informés des nouvelles guidelines et procédures. Informez et éduquez les prescripteurs et les autres parties prenantes sur les activités de l'AMS en utilisant des moyens tels que des posters, des dépliants, des bulletins d'information, des conférences, la communication électronique et l'intranet de l'hôpital.9,33 Les documents de sensibilisation à l’AMS destinés aux prescripteurs sont disponibles dans ce kit à outils.
Il ne faut pas compter sur les activités éducatives pour que les changements se fassent automatiquement. Cependant, des stratégies éducatives continues peuvent être utilisées pour compléter d'autres activités d’AMS.1 L'éducation sur l'AMS et les détails du programme AMS de l'hôpital doivent être systématiquement fournis dans le cadre de l'orientation du nouveau personnel, avec des mises à niveau régulières (trimestriel ou annuel) pour que le personnel reste informé de tout changement apporté au programme.9,33
Utilisez les ressources pédagogiques et la formation en ligne :
Un programme d'éducation en combinaison avec une intervention essentielle sert d’exemple de programme AMS qui pourrait être facilement mis en œuvre dans de nombreux hôpitaux en Afrique et au Moyen-Orient22,23
Tableau 1
Opportunités clés pour améliorer l'utilisation des antibiotiques2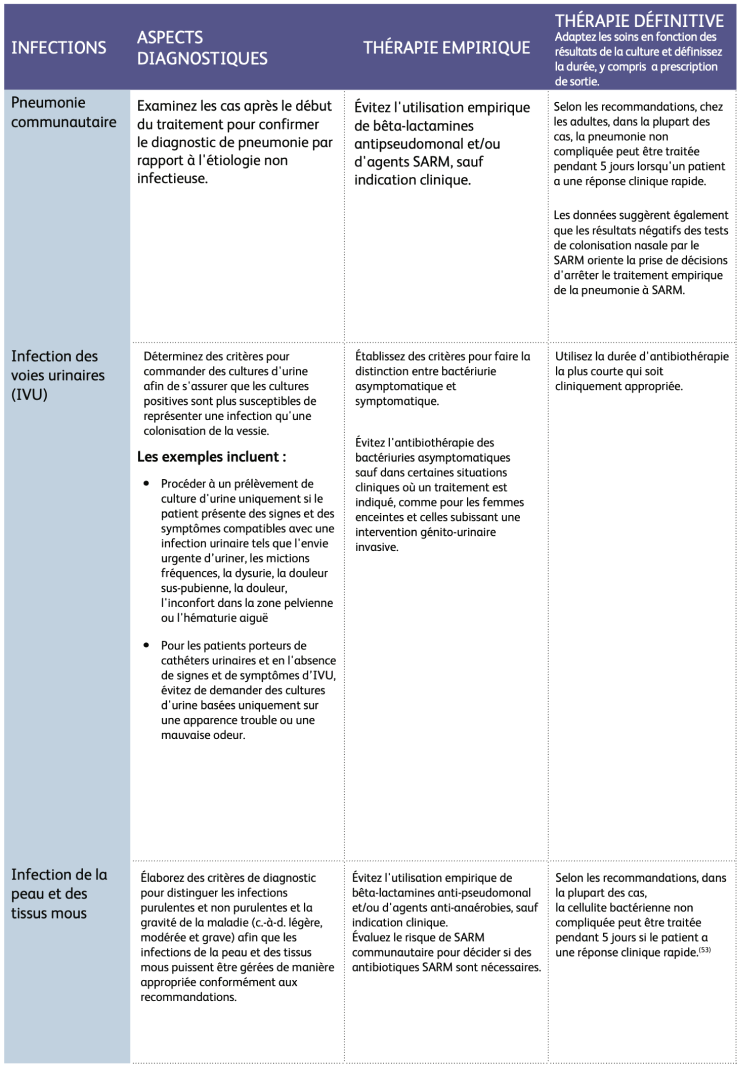
Étape 8 : Surveiller et communiquer les progrès et le succès du programme AMS
Après avoir mis en œuvre les interventions choisies, commencez à surveiller les processus et les résultats du programme AMS pour évaluer l'impact des interventions et identifier les opportunités d'amélioration.2 Au lieu de la surveillance continue, envisagez des enquêtes de prévalence ponctuelle qui nécessitent moins de ressources pour surveiller la consommation d'antibiotiques et la résistance aux antimicrobiens.2
Des réunions d'équipe régulière doivent être programmées pour examiner les activités et les données du programme AMS, et pour modifier le programme le cas échéant, en incorporant un cycle Plan-Do-Check-Act (PDCA).9 Tâchez d’organiser des réunions d'équipe AMS au moins une fois par mois pour revoir les KPI. Fournissez le feedback aux personnes concernées au sein des départements concernant la pertinence des prescriptions d'antibiotiques, le taux d'acceptation des interventions et les domaines d'amélioration recommandés. Essayez de le faire au moins une fois par trimestre ou plus fréquemment, en attendant l'intervention.a
Des rapports d'avancement annuels doivent être préparés pour l'administration de l’hôpital et d'autres groupes de parties prenantes. Citez vos succès pour obtenir plus de ressources afin de résoudre davantage de problèmes et de démontrer l'importance du programme AMS ou expliquez pourquoi le succès n'a pas été atteint (c'est-à-dire une non-conformité aux interventions) et demandez de l'aide pour trouver des solutions et surmonter les obstacles.a
Conseils généraux
Il n'existe pas d'approche unique pour la mise en œuvre d'un programme AMS, mais certaines règles générales doivent s'appliquer.2,9
Faire
- Concevez votre programme en fonction de la culture de prescription, des besoins cliniques et des ressources de l'hôpital
- Commencez par quelque chose de petit et visez à accroître les capacités au fil du temps
- Mettez en œuvre un programme AMS en conjonction avec des mesures efficaces de prévention et de contrôle des infections
- Élaborez et mettez en œuvre une guideline sur les antimicrobiens incluant une ou toutes les infections prévalentes à l'hôpital
- Surveillez l'utilisation d'au moins une classe d'antibiotiques dont on suspecte une utilisation inappropriée dans au moins une unité de l'hôpital
- Partagez votre expérience régulièrement avec les parties prenantes pour assurer un soutien continu et élargir le périmètre du programme
À ne pas faire
- Commencer en cas d’absence d'engagement de la part de la direction de l'hôpital
- Essayer de mettre en place une intervention jusqu’à ce que vous disposiez de ressources suffisantes pour le faire efficacement
- Essayer de résoudre tous les problèmes à la fois
La mise en œuvre réussie d'un programme AMS dépendra en fin de compte d'un leadership fort et d'une approche d'équipe multidisciplinaire coordonnée pour la planification et la mise en œuvre.a
Références
- Barlam TF, Cosgrove SE, Abbo LM, MacDougall C, Schuetz AN, Septimus EJ, et al. Implementing
an antibiotic stewardship program: Guidelines by the Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America. Clin Infect Dis Off Publ Infect Dis Soc Am. 2016 15;62(10):e51–e77.
- Centers for Disease Control and Prevention. Core elements of hospital antibiotic stewardship programs. 2015. Available at: https://www.cdc.gov/antibiotic-use/core-elements/hospital.html. Consulté en avril 2020.
- Centers for Disease Control and Prevention. Stewardship program examples: Success stories.
Available at: www.cdc.gov/antibiotic-use/healthcare/programs.html. Consulté en avril 2020.
- Africa Centres for Disease Control and Prevention. African Union framework for antimicrobial
resistance control 2020–2025. Available at: https://africacdc.org/download/african-unionframework-for-antimicrobial-resistance-control-2020-2025/ Consulté en juillet 2021.
- World Health Organisation. Antimicrobial stewardship programmes in health-care facilities in low- and middle-income countries: a WHO practical toolkit. October 2019. Available at: https://
www.who.int/publications/i/item/9789241515481. Consulté en juillet 2021.
- Mendelson M, Morris AM, Thursky K, Pulcini C. How to start an antimicrobial stewardship
programme in a hospital. Clin Microbiol Infect. 2020;26(4):447–53.
- Doron S, Davidson LE. Antimicrobial stewardship work : Practical stewardship. Mayo Clin Proc.
2011;86(11):113–23.
- The Joint Commission. Antimicrobial stewardship toolkit. 2013. Available at: www.jcrinc.com/ antimicrobial-stewardship-toolkit. Consulté en avril 2020.
- Patel D, Macdougall C. How to make antimicrobial stewardship work: Practical considerations for hospitals of all sizes. Hosp Pharm. 2010;45(Suppl.11):10–21.
- Duguid M and Cruickshank M (eds). Antimicrobial stewardship in Australian hospitals, January 2011. Australian Commission on Safety and Quality in Health Care, Sydney, NSW, Australia. Available at: https://www.safetyandquality.gov.au/sites/default/files/migrated/ Antimicrobialstewardship-in-Australian-Hospitals-2011.pdf. Consulté en avril 2020.
- Pew Charitable Trusts. A path to better antibiotic stewardship in inpatient settings: 10 case studies map how to improve antibiotic us in acute and long-term care facilities. 2016. Available at:
www.pewtrusts.org/~/media/
assets/2016/04apathtobetterantibioticstewardshipininpatientsettings.pdf. Consulté en avril 2020.
- Centers for Disease Control and Prevention. Strategies to assess antibiotic use to drive improvements in hospitals. Available at: www.cdc.gov/antibiotic-use/healthcare/pdfs/Strategiesto- assess-antibiotic-use-in-hospitals-508.pdf. Consulté en avril 2020.
- The Joint Commission. Antimicrobial stewardship toolkit. 2013. Available at: www.jcrinc.com/ antimicrobial-stewardship-toolkit. Consulté en avril 2020.
- Spellberg B, Bartlett JG, Gilbert DN. How to pitch an antibiotic stewardship program to the hospital C-Suite. Open Forum Infect Dis. 2016;3(4):ofw210.
- Karlowsky JA, Bouchillon SK, Kotb REM, Mohamed N, Stone GG, Sahm DF. In vitro activityof ceftazidime/avibactam against clinical isolates of Enterobacterales and Pseudomonas aeruginosa from Middle Eastern and African countries: ATLAS global surveillance programme 2015–18.JAC Antimicrob Resist. 2021;3(2):dlab067.
- Centers for Disease Control and Prevention and Institute for Healthcare Improvement. Antibiotic stewardship driver diagram. Available at: https://www.cdc.gov/antibiotic-use/healthcare/pdfs/ Antibiotic_Stewardship_Driver_Diagram.pdf. Consulté en avril2020.
- Davey P, Marwick CA, Scott CL, Charani E, McNeil K, Brown E, et al. Interventions to improve antibiotic prescribing practices for hospital inpatients.Cochrane Database Syst Rev. 2017 09;2:CD003543.
- Honda H, Ohmagari N, Tokuda Y, Mattar C, Warren DK. Antimicrobial stewardship in inpatient settings in the Asia Pacific region: A systematic review and meta-analysis.Clin Infect Dis Off Publ Infect Dis Soc Am. 2017;64(Suppl.2):S119–S126.
- Karanika S, Paudel S, Grigoras C, Kalbasi A, Mylonakis E. Systematic review and meta-analysis of clinical and economic outcomes from the implementation of hospital-based antimicrobial stewardship programs. Antimicrob Agents Chemother. 2016;60(8):4840–52.
- Schuts EC, Hulscher MEJL, Mouton JW, Verduin CM, Stuart JWTC, Overdiek HWPM, et al. Current evidence on hospital antimicrobial stewardship objectives: a systematic review and meta-analysis. Lancet Infect Dis. 2016;16(7):847–56.
- Borren NZ, Ghadermarzi S, Hutfless S, Ananthakrishnan AN. The emergence of Clostridium difficile infection in Asia: A systematic review and meta-analysis of incidence and impact.PloSOne. 2017;12(5):e0176797.
- Apisarnthanarak A, Danchaivijitr S, Khawcharoenporn T, Limsrivilai J, Warachan B, Bailey TC, et al. Effectiveness of education and an antibiotic-control program in a tertiary care hospital in Thailand. Clin Infect Dis. 2006;42(6):768–75.
- Chang Y-Y, Chen H-P, Lin C-W, Tang J-J, Hsu T-Y, Weng Y-C, et al. Implementation and outcomes of an antimicrobial stewardship program: Effectiveness of education. J Chin Med Assoc JCMA. 2017;80(6):353–9.
- Cheon S, Kim M-J, Yun S-J, Moon JY, Kim Y-S. Controlling endemic multidrug-resistant Acinetobacter baumannii in Intensive Care Units using antimicrobial stewardship and infection control. Korean J Intern Med. 2016;31(2):367–74.
- Chen I-L, Lee C-H, Su L-H, Wang Y-CL, Liu J-W. Effects of implementation of an online comprehensive antimicrobial-stewardship program in ICUs: a longitudinal study. J Microbiol Immunol Infect. 2018;51(1):55–63.
- Lew KY, Ng TM, Tan M, Tan SH, Lew EL, Ling LM, et al. Safety and clinical outcomes of carbapenem de-escalation as part of an antimicrobial stewardship programme in an ESB-Lendemic setting. J Antimicrob Chemother. 2015;70(4):1219–25.
- Park SM, Kim H, Jeong YM, Lee JH, Lee E, Lee E, et al. Impact of intervention by an antimicrobial stewardship team on conversion from intravenous to oral fluoroquinolones. Infect Chemother. 2017;49(1):31–7.
- Sing DYF, Boo YL, Mukhlis R, Chin PW, Hoo FK. Antimicrobial stewardship program in a Malaysian district hospital: first year experience. Pak J Med Sci. 2016;32(4):999–1004.
- Teo J, Kwa ALH, Loh J, Chlebicki MP, Lee W. The effect of a whole-system approach in an antimicrobial stewardship programme at the Singapore General Hospital. Eur J Clin Microbiol
Infect Dis Off Publ Eur Soc Clin Microbiol. 2012;31(6):947–55.
- Wu C-T, Chen C-L, Lee H-Y, Chang C-J, Liu P-Y, Li C-Y, et al. Decreased antimicrobial resistance and defined daily doses after implementation of a clinical culture-guided antimicrobial stewardship program in a local hospital. J Microbiol Immunol Infect. 2017;50(6):846–56.
- Liew YX, Lee W, Kwa AL-H, Chlebicki MP. Cost effectiveness of an antimicrobial stewardship programme. Int J Antimicrob Agents. 2015;46(5):594–5.
- Baur D, Gladstone BP, Burkert F, Carrara E, Foschi F, Döbele S, et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis. Lancet Infect Dis. 2017;17(9):990–1001.
- National Quality Forum. National quality partners playbook: Antibiotic stewardship in acute care. 2016. Available at: www.qualityforum.org/Publications/2016/05/National_Quality_Partners_ Playbook__Antibiotic_Stewardship_in_Acute_Care.aspx. Consulté en avril 2020.
- Dellit TH, Owens RC, McGowan JE, Gerding DN, Weinstein RA, Burke JP, et al. Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America guidelines for developing an institutional program to enhance antimicrobial stewardship. Clin Infect Dis Off Publ Infect Dis Soc Am. 2007;44(2):159–77.
- Brink AJ, Messina Ap, Feldman C, Richards GA, Becker PJ, Goff DA, et al. Antimicrobial stewardship across 47 South African hospitals. Lancet Infect Dis. 2016;16(9):1017–25.
- Wang H-Y, Chiu C-H, Huang C-T, Cheng C-W, Lin Y-J, Hsu Y-J, et al. Blood culture-guided deescalation of empirical antimicrobial regimen for critical patients in an online antimicrobial stewardship programme. Int J Antimicrob Agents. 2014;44(6):520–7.
- Public Health England. Start smart – then focus: Antimicrobial stewardship toolkit for English hospitals. 2011. Available at: www.gov.uk/government/publications/antimicrobial-
stewardshipstart-smart-then-focus. Consulté en avril 2020.
- Republic of the Philippines Department of Health. Antimicrobial stewardship program in hospitals. 2016. Available at: www.slideshare.net/phicna2005/doh-antimicrobial-stewardshipprogram-in-hospitals-manual-of-procedures-mop-2016. Consulté en avril 2020.
- Liew YX, Lee W, Tay D, Tang SSL, Chua NGS, Zhou Y, et al. Prospective audit and feedback in antimicrobial stewardship: is there value in early reviewing within 48 h of antibiotic prescription?
Int J Antimicrob Agents. 2015;45(2):168–73.
- Chan Y-Y, Lin T-Y, Huang C-T, Deng S-T, Wu T-L, Leu H-S, et al. Implementation and outcomes of a hospital-wide computerised antimicrobial stewardship programme in a large medical centre in Taiwan. Int J Antimicrob Agents. 2011;38(6):486–92.
Annexes
Annexe 1
Ressources en ligneCes tableaux fournissent des liens vers une sélection de ressources en ligne les plus utiles pour aider à la mise en œuvre des programmes hospitaliers AMS.
Annexe 3
Diapositives avec des exemples d'analyse de rentabilisation du programme AMSCes diapositives proposent des titres et des points clés aux dirigeants d’AMS qui doivent être élaborés pour aboutir à une analyse de rentabilisation d'un programme AMS à présenter devant les directeurs de l'hôpital.







